Schéma électronique dans une molécule
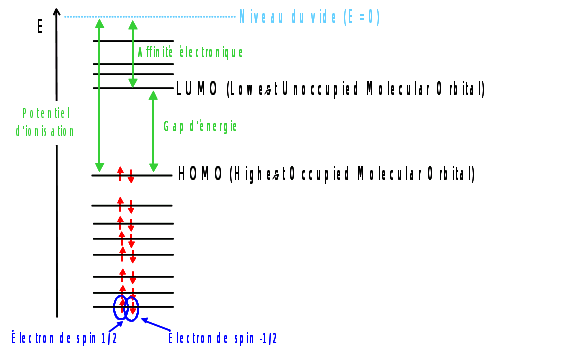
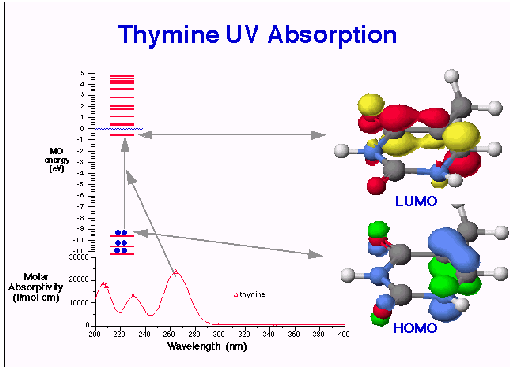
La HOMO c'est le dernier niveau d'énergie occupé.
C'est de là que partiront les électrons lors d'un transfert d'électron (un transfert redox).
Son énergie est ~ égale au potentiel d'ionisation.
Donc c'est un niveau d'énergie très important pour expliquer un certain type de réactivité de la molécule.
La LUMO c'est le premier niveau inoccupé.
C'est le niveau d'énergie qui accueille les électrons qui « sautent » vers cette molécule.
L'énergie et la position spatiale de la HOMO et de la LUMO sont importantes pour comprendre les transferts d'électrons.
Les transitions permises entre ces différents niveaux d'énergie électronique sont caractéristiques du spectre d'absorption UV/visible de la molécule.