Relations structure-activité quantitatives
Objectif
-
Trouver une relation mathématique qui relie l'activité biologique d'une molécule à différents paramètres physico-chimiques.
CI50 = Concentration pour avoir 50% d'inhibition
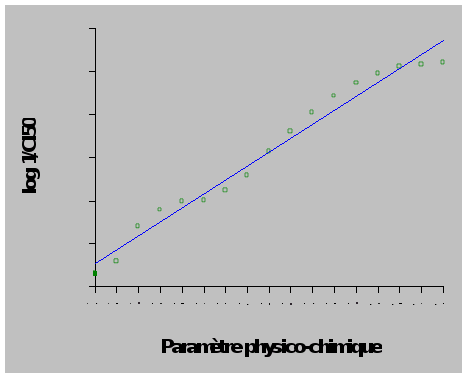
1/CI50 est proportionnel à l'activité (plus 1/CI50 est petit, plus l'activité est importante).
En réalité on visualise souvent log 1/CI50 en fonction des paramètres physico-chimiques (descripteurs).
-
Le caractère hydrophobe d'un composé est très important pour comprendre son activité biologique.
-
Le coefficient de partage est caractéristique de cette propriété.
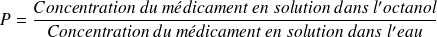
-
Les composés hydrophobes ont une valeur de P élevée.
-
Les composés hydrophiles ont un P petit.
En réalité on utilise souvent
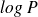 .
.
Pour de nombreux composés, on a constaté expérimentalement que l'activité biologique était reliée à
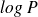 .
.
Ceci prouve que les médicaments doivent :
-
traverser des barrières hydrophobes (membranes plasmiques) pour atteindre leur cible
-
interagir avec l'enzyme (dont les sites de fixation sont souvent hydrophobes)
On ne peut pas augmenter indéfiniment l'hydrophobicité, sinon les molécules :
-
ne sont plus suffisamment solubles dans les milieux aqueux
-
sont « coincées » au niveau des dépôts adipeux (hydrophobes)
-
sont plus facilement métabolisées
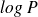 est la mesure de l'hydrophobicité de la molécule entière.
est la mesure de l'hydrophobicité de la molécule entière.
Il est souvent intéressant de regarder l'hydrophobicité d'un substituant particulier.
On la mesure par rapport à l'atome d'hydrogène, à l'aide du coefficient
 :
:
 > 0 : le substituant est plus hydrophobe que l'hydrogène
> 0 : le substituant est plus hydrophobe que l'hydrogène
 < 0 : le substituant est moins hydrophobe que l'hydrogène
< 0 : le substituant est moins hydrophobe que l'hydrogène
On s'intéresse souvent à l'effet de différents groupes substituant parce que l'on travaille sur des séries de molécules (construite à partir d'un composé « tête de série » actif).
La structure électronique des molécules est très importante pour expliquer son activité.
-
Transferts redox
-
Réactivité
-
Polarité
On peut utiliser le coefficient de Hammett qui permet d'évaluer le caractère électroattracteur ou électrodonneur d'un substituant.
On peut également utiliser la HOMO et la LUMO.
On sait que l'encombrement stérique d'une molécule est important pour expliquer l'activité au niveau d'un récepteur.
Mais il est difficile de les prendre en compte quantitativement.
-
Facteur de Taft (ES)
-
Paramètre de Verloop
Les programmes de chimie quantique peuvent calculer la répartition des charges dans les molécules ioniques (anions et cations).
Les interactions qui en découlent sont importantes, notamment en présence d'un solvant.
On peut également calculer la densité de spin dans les radicaux (molécules possédant un électron non apparié). Les radicaux sont des espèces qui peuvent se former, de manière transitoire, dans l'organisme au moment où les molécules exercent leur action chimique.
La connaissance des structures électroniques de ces espèces intermédiaires permet d'expliquer en partie la réactivité.
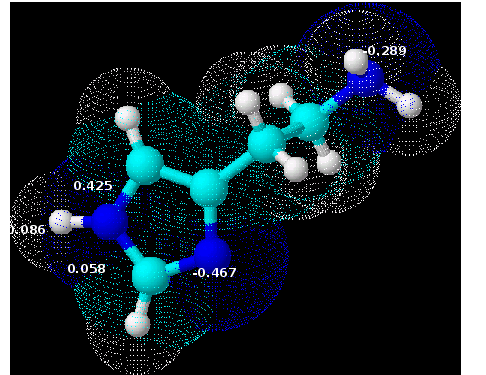
Si on la considère dans sa globalité, une molécule est neutre, donc sa charge est nulle.
Cependant, certains atomes sont plus ou moins électronégatifs (c'est-à-dire qu'ils « attirent » plus ou moins les électrons vers eux).
Donc dans une molécule, la distribution de charges n'est pas uniforme.
Certaines zones sont légèrement positives, certaines zones légèrement négatives.
Cela influence fortement les
interactions avec le site actif.
Dans une liaison entre deux atomes de caractères électronégatifs différents, les charges négatives s'accumulent sur les plus électronégatif.
L'autre atome se charge alors positivement.
Il se crée alors un dipôle électrique.
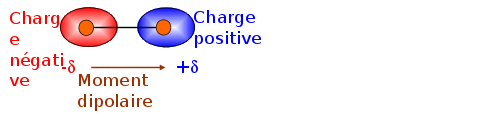
Ce dipôle est caractérisé par un moment électrique.
C'est un vecteur dont l'intensité est mesuré en Debye.
Le moment est souvent utilisé pour expliquer l'activité d'une molécule parce qu'il peut être directement relié à sa réactivité chimique.
Ces deux paramètres, longtemps réservés à la physique et à la chimie théorique, commencent à être utilisés pour expliquer l'activité biologique des molécules (liée à l'interaction médicament/récepteur).
Des transferts de charge sont possible entre l'orbitale HOMO d'un composé et l'orbitale LUMO d'un deuxième composé.
Il peut s'agir d'un transfert de charge entre une molécule et une partie d'un site de fixation. On explique ainsi l'implication de ces niveaux d'énergie dans l'activité biologique de la molécule
On peut également calculer les enthalpies de dissociation de certaines liaisons chimiques, impliquées dans le réactivité de la molécule.
Cette énergie (ou enthalpie) est calculée en kcal/mol.
Plus elle est faible plus il est facile « d'arracher » un atome d'hydrogène (réaction très courante dans la réactivité des molécules).
-
Potentiel d'ionisation
-
Affinité électronique
-
Les liaisons hydrogène
-
Polarisabilité
-
Le nombre de groupes OH
-
...
On peut calculer l'ensemble des propriétés physico-chimiques et les relier à l'activité biologique.
On forme ainsi une équation mathématique, appelée équation de Hansch :
Plus le coefficient
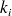 est grand, plus le paramètre physico-chimique correspondant est important.
est grand, plus le paramètre physico-chimique correspondant est important.
C'est un moyen empirique pour connaître et comprendre ce qui influence une activité biologique.
Activité antioxydante et anti-inflammatoire de la molécule suivante :
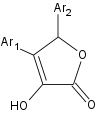
Weber et al. (Bioorganic & Medicinal Chemistry, 10, 1646-1658, (2002)) ont obtenu :
On notera l'importance de la HOMO
