Rappels de thermodynamique
Notion de système thermodynamique
Un système thermodynamique est une région de l'univers dans laquelle s'effectue la transformation que l'on étudie. Dans le cas des enzymes, il peut s'agir du tube à essai dans lequel a lieu la réaction enzymatique ou une cellule, ou un tissu ou liquide biologique, siège de réactions métaboliques régulées par des enzymes. Le système est isolé s'il n'y a pas d'échange avec le milieu extérieur ; il est fermé s'il y a échange d'énergie mais pas de matière ; enfin, il est ouvert dans le cas d'échanges possibles d'énergie et de matière, c'est le cas des systèmes biologiques. Un système fermé tend à évoluer spontanément vers un état d'équilibre ; ainsi dans le cas d'une réaction chimique où deux réactants A et B sont transformées en C et D dans le sens aller de gauche à droite, et inversement de droite à gauche dans le sens retour :
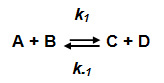
avec Keq (constante thermodynamique de l'équilibre ou plus simplement constante d'équilibre), qui s'exprime en fonction des concentrations des réactants mesurées à l'équilibre :
Keq = [C].[D]/[A].[B] = k1/k-1
Keq est donc aussi le rapport des constantes de vitesse « aller » (k1) et « retour » (k-1).
Premier principe de thermodynamique et enthalpie libre
Le premier principe de la thermodynamique stipule que l'énergie de l'univers est constante, et qu'ainsi au cours d'une transformation, l'échange d'énergie entre le système et le milieu extérieur est égal à la variation d'enthalpie (ΔH) du système, telle que :
ΔH = H2 - H1 = Q + W
H1 et H2 représentant l'enthalpie du système avant et après transformation, respectivement, Q l'échange d'énergie sous forme de chaleur, et W l'échange d'énergie sous forme de travail. Ainsi tout système possède une enthalpie, énergie dont seule une partie est susceptible d'être cédée au milieu extérieur sous forme de travail. Cette quantité d'énergie utile est appelée enthalpie libre, ou encore énergie libre de Gibbs (G). On ne sait pas la mesurer, mais on peut évaluer ses variations (ΔG) :
ΔG = ΔH - TΔS
ΔS étant la variation d'entropie, qui mesure le degré de désordre du système ; TΔS représente ce qui n'est pas transformable en travail, T étant la température (en °K). ΔG est la variation d'énergie libre de la réaction ; c'est cette variable qui est la plus utilisée par les biochimistes, car elle représente la quantité de travail disponible pour réaliser la réaction. Quand ΔG < 0, la réaction est exergonique, donc thermodynamiquement possible spontanément, c'est-à-dire sans apport extérieur d'énergie. Quand ΔG > 0, la réaction est endergonique, donc thermodynamiquement impossible spontanément, c'est-à-dire qu'elle nécessite un apport extérieur d'énergie. ΔG est exprimée en kJ.mole-1, plutôt qu'en kilocalories/mole, qui fait référence à des réactions exothermiques et endothermiques, exclusivement reliées à des quantités d'énergie échangées sous forme de chaleur.
Dans la transformation précédente, on peut relier ΔG à la constante d'équilibre Keq selon :
ΔG = ΔG° + R.T.LnKeq
avec ΔG° = variation d'énergie libre standard ; R = constante des gaz parfaits (8,32 J.mol-1.K-1) ; et T = température absolue en degrés Kelvin (°K). Les concentrations des réactants, dont celle des ions H+, sont molaires (1 mole.L-1), donc pH = 0, et la pression est égale à 105 Pa soit 0,1 MPa. Ces conditions sont peu adaptées à la vie sur terre. En biochimie, on utilise ΔG'°, variation d'énergie libre standard en biochimie, donnée pour une pression de 1 bar (pression moyenne sur terre), un pH de 7 signifiant que [H+] = 10-7 mole.L-1, une température en °C (0 °C = 273 °K), et pour une mesure effectuée en milieu aqueux (H2O = 55,5 M). Lorsque l'équilibre est atteint, la variation d'énergie libre est nulle (ΔG = 0), soit :
ΔG° = - R.T.LnKeq
On peut donc relier ΔG'° à Keq directement; ainsi quand ΔG < 0, K > 1 (l'équilibre est déplacé spontanément vers la droite), et quand ΔG > 0, K < 1 (l'équilibre est déplacé vers la gauche).