Rappels sur les cinétiques des réactions chimiques
Considérons la transformation de A en B : A --> B
- Réaction d'ordre 0 : v = - dA/dt = dB/dt = k0
La vitesse (v) ne varie pas en fonction de la concentration des réactants (A et B) ; elle est constante (k0).
- Réaction d'ordre 1 : v = - d(A0 - x)/dt = k1.(A0 - x)
La vitesse varie en fonction de la concentration de l'un des réactants, ici A = A0 - x ; elle n'est donc pas constante. Elle est difficilement mesurable, puisqu'en décroissance continue.
- Réaction d'ordre 2 : A + B --> C + D
Ici considérons une réaction bi-moléculaire, A réagit avec B pour former C et D; si la vitesse varie en fonction de la concentration de l'un des réactants (A ou B), elle est d'ordre 1 ; elle est d'ordre 2 si elle varie en fonction de la concentration des deux réactants. Là encore il sera difficile de mesurer une vitesse. Par contre, cette réaction bi-moléculaire peut être d'ordre 0 si elle ne varie pas en fonction de la concentration des réactants, la vitesse sera constante là aussi. La vitesse peut ainsi être constante quel que soit le nombre de réactants, donc pour les enzymes, le nombre de substrats et de produits.
- Réaction réversible :
On peut définir une constante à l'équilibre (Keq), et exprimer les vitesses « aller » (de A vers B) et « retour » (de B vers A) en fonction des constantes cinétiques « aller » (k1) et « retour » (k-1).
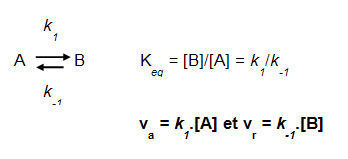
Beaucoup d'enzymes catalysent des réactions réversibles ; certaines de ses réactions sont à l'équilibre thermodynamique, c'est-à-dire que les deux sens sont thermodynamiquement favorables, la réaction étant déplacée dans le sens induit par les concentrations des réactants.