Structure et propriétés physico-chimiques
![]() EFFETS ÉLECTRONIQUES
EFFETS ÉLECTRONIQUES
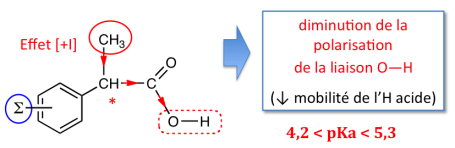
Le substituant CH3 sur le carbone voisin du groupement acide possède essentiellement un rôle électronique : en raison de son effet inductif [+I] le groupe méthyle repousse les électrons le long de la simple liaison (σ). À l'égard du motif acide, cela se traduit par une diminution de la polarisation de la liaison O—H. La mobilité de l'hydrogène se trouve réduite : il en résulte une diminution de la force de l'acide.
Par rapport aux dérivés AINS arylacétiques, les arylpropioniques ont des valeurs de pKa supérieures. Ce sont des acides faibles dont les effets indésirables digestifs sont moins prononcés qu'avec les autres anti-inflammatoires.
![]() STÉRÉOCHIMIE
STÉRÉOCHIMIE
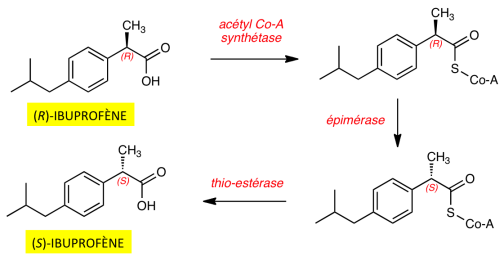
Dans la série des AINS arylpropioniques, le carbone en α du groupe acide est un centre chiral. Seul l'énantiomère (S) est vecteur de l'activité anti-inflammatoire. Administrés sous forme de racémiques (R + S), les dérivés arylpropioniques subissent un métabolisme particulier, avec inversion de la configuration du centre asymétrique. À titre d'exemple, l'inversion chirale du (R)-ibuprofène est représentée dans le schéma suivant :
Remarque :
Cette inversion chirale est observée pour tous les AINS arylpropioniques. La transformation métabolique de la forme inactive (R) en énantiomère actif (S) explique que ces anti-inflammatoires sont utilisés sous forme de racémiques.






