Niveaux d'énergie d'excitation des molécules
-
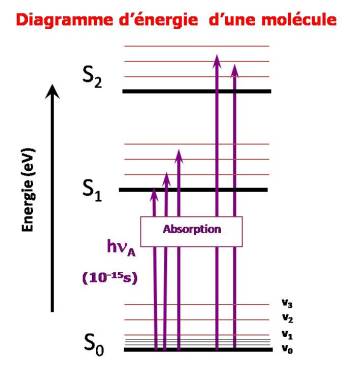
Le diagramme d'énergie d'une molécule est plus complexe que pour l'atome car en plus des niveaux électroniques, il y a d'autres niveaux car la molécule peut absorber de l'énergie par d'autres mécanismes.
-
Niveaux d'excitation électroniques
-
Les électrons sont situés sur des orbitales moléculaires.
-
L'absorption d'un photon dénergie appropriée (domaine UV-Visible) fait passer une molécule de l'état fondamental à un état électronique excité. Une telle transition correspond au passage d'un électron dans une orbitale inoccupée d'énergie supérieure.
-
Un électron pourra passer sur une orbitale vide, il y a donc une série de niveaux.
-
-
Niveaux de vibration
-
Les liaisons entre atomes ne sont pas rigides, les atomes vibrent naturellement les uns par rapport aux autres.
-
En cas d'apport d'énergie extérieure le phénomène de vibration augmente : augmentation de l'énergie de vibration.
-
On appelle Evib l'énergie absorbée de cette manière.
-
L'énergie vibrationnelle présente 2 caractéristiques :
-
Evib << Eel
-
Evib est quantifiée.
-
-
-
Niveaux de rotation
-
Si la molécule est libre de ses mouvements elle peut tourner autour de son centre de gravité.
-
Ce phénomène existe dans les gaz et les vapeurs mais est négligeable dans les liquides et les solides.
-
Erot << Evb<<Eel
-
-
Représentation des niveaux d'énergie de la molécule :