Les concentrations
Une solution est caractérisée par la nature de ses constituants et leurs proportions
La fraction molaire fi d'un soluté est le rapport du nombre de moles ni du composé i sur la somme de toutes les moles présentes dans la solution , y compris les n0 moles de solvant.
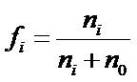 fraction_molaire | fi = fraction molaire du soluté (compris entre 0 et 1) (somme fi = 1) ni = nombre de moles de soluté n0 + ni = ntot = nombre de moles total (solvant + soluté) |
La concentration pondérale, Cp, représente la masse de soluté par unité de volume. Elle est généralement donnée en g.L-1.
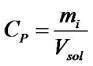 conc_ponderale | Cp = concentration pondérale en g.L-1 ou kg.m-3 mi = masse de soluté en g ou en kg Vsol = volume de solution en L ou en m3 |
Dans les unités internationales , on notera les concentrations en kg.m-3 (Notons que 1g.L-1 = 1kg.m-3)
La concentration molaire est la quantité de matière de soluté (exprimée en moles) par unité de volume..
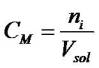 conc_molaire | CM = concentration molaire en mol.L-1 (mole par litre) ni = nombre de moles de soluté Vsol = volume de solution en litre |
La concentration ionique représente le nombre de moles d'ions par unité de volume.
conc_ionique | CI = concentration ionique en moles d'ions par litre CM = concentration molaire en mol.L-1 (mole par litre) v = nb d'ions libérés par molécule totalement dissociée |
La concentration osmolaire Cosm est la concentration de particules osmotiquement actives en solution, exprimée en termes d'osmoles de soluté par litre de solution. L'osmolarité représente le nombre total de moles de tous les solutés par litre de solution.
conc_osmolaire | Cosm = concentration osmolaire ou osmolarité en osm.L-1. CM = concentration molaire en mol.L-1 β = nombre de particules libérées par une molécule
|
NB : Pour les molécules non électrolytes (non dissociées ou solides), l'osmolarité est la molarité.
Ne pas confondre l'osmolarité (nb d'osmoles de soluté par litre de solution) et l'osmolalité (nb d'osmoles de soluté par kilogramme de solvant)
