Isoforme COX-1
La structure tridimensionnelle de la COX-1 a été établie au début des années 1990 par étude radiocristallographique (PICOT et al, 1994). Le domaine catalytique est constitué d'un long canal hydrophobe relativement étroit (dimensions : 25 × 8 Å).
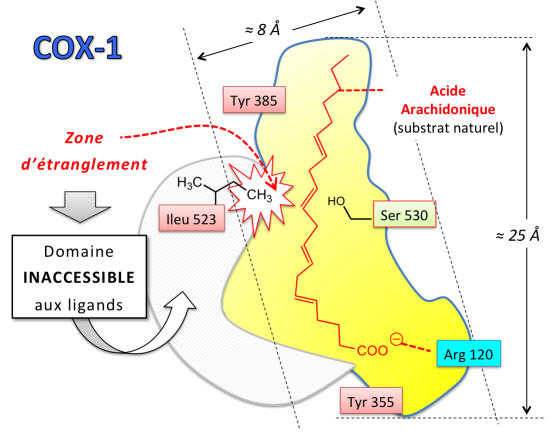
Divers amino-acides participent au fonctionnement de l'enzyme, soit par effet électronique, soit par effet stérique :
L'Arginine 120, située à l'entrée du site actif, possède une chaîne latérale porteuse d'une fonction guanidine, facilement protonable. La charge cationique joue un rôle clé dans l'ancrage du substrat naturel de l'enzyme (interaction électrostatique avec le groupement carboxylate de l'acide arachidonique).
La Tyrosine 385, située à l'autre extrémité du site, participe à l'activité cyclooxygénase en provoquant l'arrachement stéréospécifique de l'atome d'hydrogène en position 13 de l'AA.
La Sérine 530, au niveau de la partie centrale du site actif, intervient par sa chaîne latérale à fonction alcool. Ce résidu polaire impose une certaine courbure à la molécule d'AA, nécessaire à l'action de l'enzyme sur son substrat.
L'Isoleucine 523 est responsable d'un effet stérique en raison de sa chaîne latérale isobutyle. Ce motif ramifié génère une zone d'étranglement dans la partie centrale du site catalytique de la COX-1.






