Isoforme COX-2
La structure 3D de la COX-2, déterminée en 1996 par LUONG et coll., a permis de constater une grande similitude entre les deux isoformes : il existe environ 60 % d'homologie dans les séquences peptidiques.
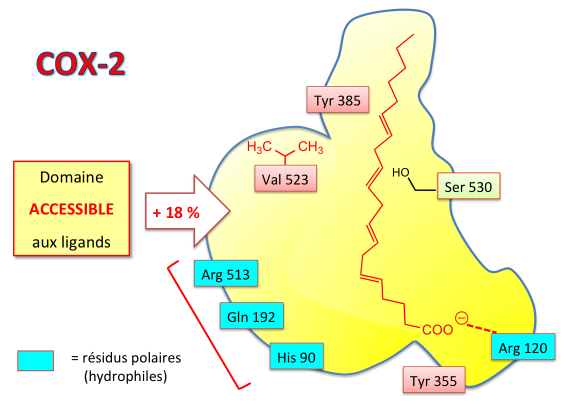
Les amino-acides essentiels à la fixation du substrat (Arg120) ou à la réaction d'oxygénation (Tyr385) sont également retrouvés dans la COX-2. Toutefois, des remplacements ponctuels de certains résidus vont entraîner des modifications d'ordre stérique au niveau du site enzymatique :
Le site actif COX-2 est dépourvu de l'isoleucine 523 et possède à la place une valine dont le groupement isopropyle est plus petit par rapport à l'isobutyle. La perte d'un groupe CH3 permet de diminuer l'encombrement stérique : il se crée un passage vers une poche latérale qui devient alors accessible à des molécules relativement volumineuses.
Cette poche latérale se distingue par certains résidus à caractère polaire : Arginine (Arg), Glutamine (Gln), Histidine (His).






