Carboplatine
![]() En milieu NEUTRE : le CARBOPLATINE se distingue des autres complexes de platine par une exceptionnelle stabilité en milieu aqueux neutre. En l'absence de tout autre nucléophile étranger, aucun échange n'est décelable, même après plusieurs mois à 25 °C.
En milieu NEUTRE : le CARBOPLATINE se distingue des autres complexes de platine par une exceptionnelle stabilité en milieu aqueux neutre. En l'absence de tout autre nucléophile étranger, aucun échange n'est décelable, même après plusieurs mois à 25 °C.
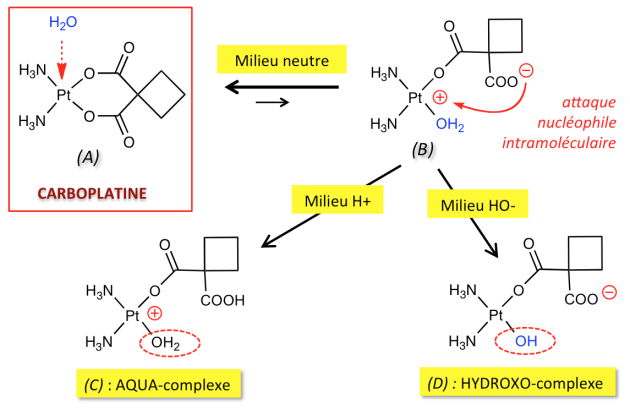
À pH neutre, l'échange entre un ligand carboxylato et une molécule d'eau conduit théoriquement à l'ouverture du cycle hexagonal du CARBOPLATINE (A). Le complexe ouvert (B) porte à la fois une charge positive au voisinage du métal et une charge négative sur le groupement carboxylate libéré. La proximité des deux sites chargés favorise une attaque nucléophile intramoléculaire et donc le retour vers (A). En d'autre termes, l'équilibre est très fortement déplacée vers la gauche (c'est-à-dire, en faveur du complexe "fermé" A).
![]() En milieu ACIDE : la protonation du groupement carboxylate de la forme (B) fait disparaître la charge négative. L'attaque nucléophile intramoléculaire n'est plus possible et la réaction évolue vers l'AQUA-complexe (C).
En milieu ACIDE : la protonation du groupement carboxylate de la forme (B) fait disparaître la charge négative. L'attaque nucléophile intramoléculaire n'est plus possible et la réaction évolue vers l'AQUA-complexe (C).
![]() En milieu BASIQUE : le fort caractère nucléophile de l'anion hydroxyle favorise la formation de l'HYDROXO-complexe (D).
En milieu BASIQUE : le fort caractère nucléophile de l'anion hydroxyle favorise la formation de l'HYDROXO-complexe (D).






