3. L'examen cytobactériologique des urines : ECBU
3.1. Dépistage de l'infection urinaire : les tests rapides d'orientation
Ils sont réalisés souvent « au lit du patient ».
Ils permettent d'évaluer la présence de leucocytes (évaluation de la réaction inflammatoire suite à la présence de bactéries dans le tractus urinaire) et de nitrites (pour les bactéries qui réduisent les nitrates en nitrites).
Les bandelettes réactives permettent d'évaluer la concentration en leucocytes par le relargage de leurs estérases. Ces estérases vont hydrolyser un ester d'indoxyle incolore présent sur la bandelette en le transformant en un composé coloré. L'intensité de la coloration permettra d'évaluer approximativement la concentration leucocytaire.
Les bandelettes réactives permettent aussi de détecter la présence de nitrites produits par l'action des nitrates réductases bactériennes, enzymes possédées par certaines bactéries, comme les entérobactéries (E. coli, ...).
La valeur prédictive négative est supérieure à 95 % dans les cystites simples.
3.2. L'examen cytobactériologique des urines : ECBU
L'infection de l'arbre urinaire est provoquée par une pullulation microbienne. Elle est suivie d'une réaction inflammatoire locale de l'organisme : afflux cellulaires en particulier de polynucléaires neutrophiles. L'ECBU comportera une cytologie quantitative pour mettre en évidence cette réaction inflammatoire et une analyse bactériologique des urines.
Il consiste à dénombrer, dans un hématimètre, les éléments nucléés (leucocytes) (voire les hématies) , présents par ml d'urines, et de noter éventuellement la présence de cylindres, de cristaux , ...
A l'état normal, les leucocytes et les hématies sont inférieurs à 104/ml d'urines.
En cas d'infection, le processus inflammatoire se traduit par l'augmentation du nombre de leucocytes (polynucléaires neutrophiles), souvent plus de 105/mL d'urine.
La présence d'hématies est variable, et peut être liée à l'agression de la muqueuse (bactéries, lithiase, tumeur, ...).
3.2.2.1. L'examen microscopique direct
-
Un frottis est réalisé à partir des urines et coloré par la méthode de Gram.
-
Il permet de mettre en évidence les bactéries à l'examen direct.
-
D'après le Gram et la morphologie, il est possible d'avoir une orientation sur l'étiologie de l'infection urinaire et donc d'orienter le traitement et de compléter éventuellement les milieux de culture.
3.2.2.2. Détermination quantitative de la bactériurie par ensemencement des urines sur milieux de culture adaptés
-
Milieux utilisés pour les bactéries habituellement impliquées : CLED (cystine-lactose – électrolyte déficient), milieux chromogènes (UTI® oxoïd, CPS® bioMérieux, ...). Les milieux chromogènes permettent de différencier plus facilement les colonies et l'identification directe des E. coli.
-
La quantification des bactéries peut s'effectuer par dilution des urines et ensemencement (en étoile), par la technique de l'anse calibrée (abaque) ou par la technique de la lame immergée. Le dénombrement des colonies, après 24 à 48 heures d'incubation à 37°C permet de quantifier la bactériurie.
3.2.2.3. Identification et antibiogramme sur l'espèce bactérienne responsable de l'infection
Le choix des galeries dépend de l'agent infectieux suspecté et le choix des antibiotiques étudiés dépend de la bactérie impliquée et du site infectieux à traiter.
-
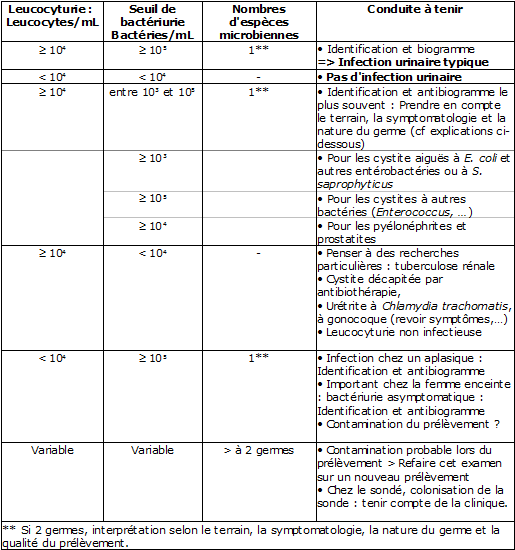
Selon Kass, :
-
bactériurie inférieure à 103 bactéries/ml = absence d'infection
-
bactériurie supérieure ou égale à 105 bactéries/ml = infection
-
bactériurie entre 103/ml et 105/ml = zone d'incertitude
-
-
Ces critères d'interprétation de la bactériurie sont affinés en tenant compte de la leucocyturie, du contexte clinique, de maladies sous-jacentes, de l'état des défenses immunitaires et de l'espèce bactérienne isolée.