1.2. Isoformes de la cyclooxygénase : aspects moléculaires
ÉTUDE COMPARATIVE DES SITES ACTIFS
Les deux isoformes partagent le même substrat naturel : ACIDE ARACHIDONIQUE.
-
La COX-1 est normalement présente dans la plupart des tissus (c'est l'isoforme constitutive).
-
La COX-2 est présente à l'état physiologique dans de rares tissus (rein, SNC). Cette isoforme est induite dans diverses circonstances pathologiques :
— états inflammatoires,
— certains processus cancéreux (cancers digestifs : colon, foie, pancréas),
— certaines maladies dégénératives du SNC.
Les structures tridimensionnelles des deux récepteurs enzymatiques ont été établies par radiocristallographie et sont connues depuis 1994 (COX-1) et 1996 (COX-2).
Il existe une très grande analogie dans les séquences d'aminoacides des deux isoenzymes : les différences ne portent que sur quelques résidus seulement.
-
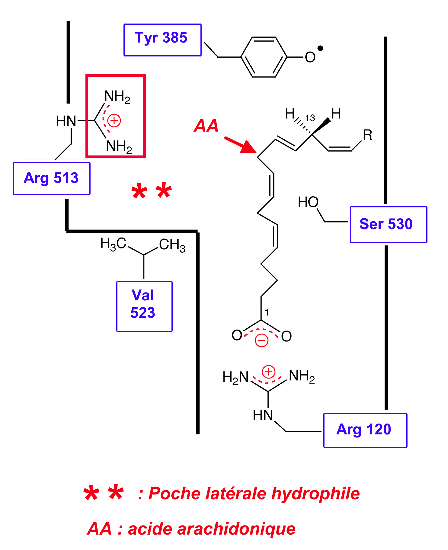
Site actif de la COX-1 (figure 2)
Le site récepteur est constitué d'un long canal hydrophobe relativement étroit (dimensions : 25 × 8 Å). Certains aminoacides sont importants dans les interactions enzyme/substrat :
— L'Arginine 120, (sous forme de cation guanidinium au pH physiologique). Ce site positif permet l'établissement d'une liaison ionique avec le groupement carboxylate de l'AA chargé négativement.
— La Tyrosine 385, sous forme radicalaire, situé à proximité du C13 de l'AA : ce radical tyrosyle permet l'arrachement d'un atome d'H à partir du substrat.
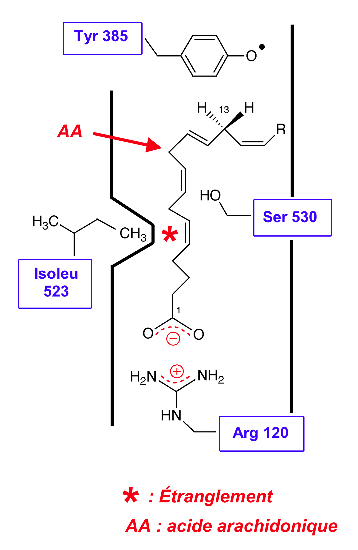
— L'isoleucine 523, est caractéristique de la COX-1. La chaîne latérale isobutyle apporte un certain encombrement stérique : ce motif est responsable d'un étranglement du site récepteur.
-
Site actif de la COX-2 (figure 3)
Cette isoforme possède deux particularités :
— une particularité géométrique
La COX-2 est caractérisée par une taille plus grande de son site récepteur (+ 20%, par rapport à COX-1).
Explication : L'isoleucine 523 a été remplacée par une valine. Le raccourcissement de la chaîne latérale d'un seul atome de C suffit pour supprimer la zone d'étranglement : cela permet alors l'accès à une poche qui agrandit le volume du récepteur.
— une particularité électronique
La poche latérale du récepteur contient une arginine (Arg 513), caractéristique de la COX-2. Ce résidu, ionisé au pH physio, fait apparaître une charge positive supplémentaire : ce site cationique est fondamental dans le mode d'action des inhibiteurs sélectifs de COX-2.