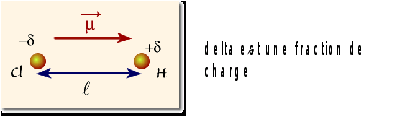Polarisation des liaisons
Lorsque deux atomes sont identiques (H2, O2...), le doublet d'électrons appariés « se trouve » à moitié « sur » le premier atome et à moitié « sur » le deuxième.
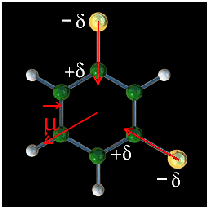
Lorsque les atomes sont différents, il y en a toujours un plus électronégatif que l'autre.
Le doublet est alors plus présent du côté de cet atome, qui portera un excès de charges négatives.
La liaison est polarisée, la molécule est polaire.
L'état de polarisation d'une liaison est caractérisé par son moment dipolaire. Le moment dipolaire est une grandeur vectorielle. Il est orienté du pôle négatif vers le pôle positif.
Il est exprimé en Debye (D).
Les charges partielles
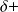 et
et
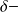 ont une valeur absolue comprise entre 0 et 1.
ont une valeur absolue comprise entre 0 et 1.
Le cas limite
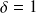 est celui où l'un des deux atomes est très électronégatif et « accapare » la totalité du doublet.
est celui où l'un des deux atomes est très électronégatif et « accapare » la totalité du doublet.
On parle alors de liaison ionique.
En réalité
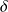 n'est jamais supérieur à 0.9.
n'est jamais supérieur à 0.9.
En chimie, on considère souvent la liaison ionique comme un autre type de liaison chimique.
C'est en réalité un cas particulier de liaison covalente.