Les liaisons faibles (ou forces de Van der Waals)
Les forces de Van der Waals sont de trois types.
-
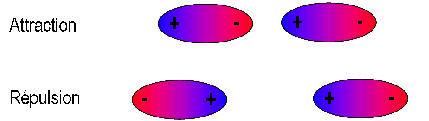
Des interactions dipôle permanent - dipôle permanent
Il existe des forces électrostatiques entre deux molécules polaires.
Le pôle + d'une molécule attire le pôle – d'une molécule voisine.
Ces interactions participent à la cohésion des systèmes.
-
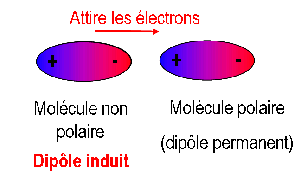
Des interactions dipôle permanent – dipôle induit
Ce type d'interaction peut également exister entre une molécule polaire et une molécule non polaire.
La molécule polaire crée un champ électromagnétique autour d'elle.
Le pôle + de la molécule polaire attire les charges négatives de la molécule non polaire (voisine) de son côté.
Interactions dipôle induit – dipôle permanent
-
Des interactions dipôle instantané - dipôle instantané
Dans les atomes et les molécules neutres et non polaires, les électrons « se déplacent », créant ainsi des dipôles instantanés.
Des interactions peuvent exister entres ces dipôles et participer à la cohésion de la molécule.
Énergie de la liaison de Van der Waals entre deux atomes i et j :
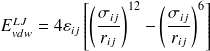
A titre de comparaison l'énergie d'une interaction électrostatique (liaison non covalente) entre 2 charges i et j est :
la liaison de Van der Waals est une interaction faible mais à longue distance ; l'énergie de cette liaison diminue lentement avec la distance entre les atomes (Ar-12 - Br-6)
