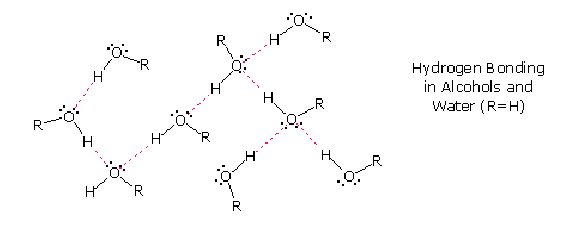
La liaison hydrogène
Ce type de liaison existe entre des atomes d'hydrogène et des atomes très électronégatifs (O, N, F).
Les liaisons O-H, N-H... sont fortement polarisées et favorisent les interactions dipôle-dipôle.
De plus, ces atomes sont « petits », les centres positifs et négatifs peuvent être très proches pour former des attractions fortes.
Ces interactions impliquent toujours un atome d'hydrogène, d'où le nom de liaison hydrogène ou pont hydrogène.
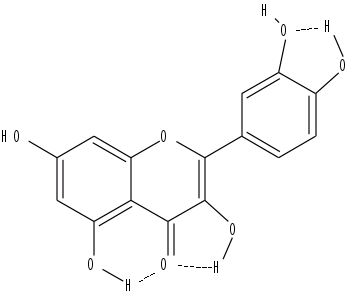
Exemple
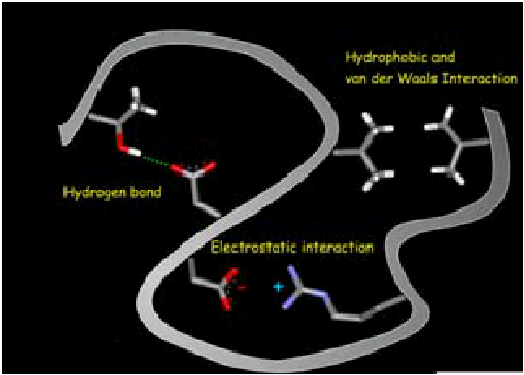
Les interactions moléculairesInfo3