Forces de Keesom
Il s'agit d'interactions entre molécules polaires = interaction dipôle-dipôle
-
Deux molécules polaires possédant des moments de dipôles non-nuls p1 et p2 peuvent trouver des orientations favorables pour maximiser l'attraction entre elles.
-
Les dipôles ont tendance à se réorienter et à s'aligner pour minimiser l'énergie.
-
L'énergie d'interaction n'est efficace qu'à courte distance.
Energie moyenne d'interaction E | 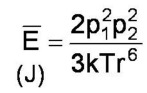 en_keesom |
Remarque
-
L'énergie moyenne d'interaction diminue très vite quand r augmente (en 1/r6)
-
E dépend de T : si T augmente , le désordre augmente et donc E diminue.
-
Ces interactions sont partiellement responsables de la cohésion des liquides constitués de molécules polaires.
