Les liaisons Hydrogène
Très important en biologie les liaisons hydrogène assurent la stabilité de nombreux biopolymères, protéines, acides nucléiques.
La liaison hydrogène est une liaison chimique non covalente de type dipôle-dipôle entre 2 molécules ou entre 2 groupements d'une molécule.
Nature de la liaison : Elle consiste essentiellement dans l'interaction entre deux molécules :
-
1 molécule possédant un atome donneur d'électrons (O, N, F)
-
1 molécule possédant un atome H accepteur d'électrons (OH, NH2)
La liaison résulte d'un transfert partiel d'un e- célibataire sur le groupement H.
Les liaisons hydrogène peuvent être intramoléculaires ou intermoléculaires.
Exemples de liaisons Hydrogène
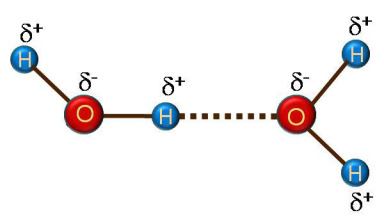
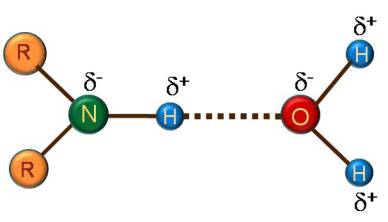
Le rôle des liaisons hydrogène est très important en en chimie et en biochimie.
Ce sont ces liaisons qui donnent à l'eau ses propriétés particulières, comme la capacité des molécules H2O à s'associer en grandes structures.
Les liaison hydrogène jouent en outre, un rôle stabilisateur de la structure secondaire des macromolécules biologiques.
-
liaisons H dans :
-
les prot (structure IIIaire et IVaire),
-
les acides nucléiques (double hélice stabilisée par de liaisons H),
-
les interactions moléculaires (reconnaissance de petites molécules par des récepteurs ...)
-
