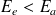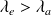Spectres d'émission
*Les spectres d'émission des atomes dépendent du diagramme d'énergie et des conditions d'excitation.
-
Excitation en E1 et émission de E1 à E0 : spectres de flamme (une raie d'émission)
-
Excitation des niveaux de différentes énergies (E1, E2, E3 ...) et émission entre les différents niveaux : spectres de raies (étincelle) plusieurs raies d'émission.
*Ces spectres d'émission des atomes
-
sont obtenus pour des gaz rares ou des minéraux NaCl, BaCl2, LiCl ...
-
permettent une identification des atomes
-
permettent une analyse quantitative par comparaison des intensités des raies
-
L'énergie absorbée par les molécules est rapidement dissipée sous forme de chaleur par des processus non radiatifs tels que :
-
la relaxation vibrationnelle
-
la conversion conversion interne (c.i.)
-
-
Ainsi une molécule excitée à un niveau élevé (état S2 ou supérieur) est rapidement désexcitée et atteint l'état excité métastable S1. C'est à partir de ce niveau que peut se produire l'émission de fluorescence.
-
Les différents processus sont représentés sur le diaporama ci-dessous.
Le diaporama peut être visualisé en plein écran, pour cela cliquer sur le bouton en bas à droite de la barre de défilement. Cliquer ensuite sur l'écran pour faire apparaître les différents éléments de la présentation. La touche Echap permet de quitter le diaporama.
Cliquer sur le lien ci-dessous pour visualiser le diaporama
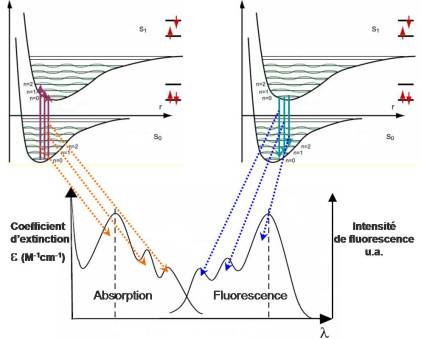
Quand un transition électronique se produit (excitation) les forces de liaison chimique, la distance d'équilibre des atomes, la fréquence de vibration se trouvent modifiées de telle sorte que la forme et la position de la courbe d'énergie potentielle peuvent se trouver altérées.
-
Le spectre de fluorescence est décalé vers les grandes longueurs d'onde par rapport au spectre d'absorption. Ceci est du à la désexcitation vibrationnelle jusqu'au niveau E1v0.
-
Les photons émis sont de plus faible énergie que les photons d'excitation.
-
La distance entre les maxima d'excitation et d'émission s'appelle le déplacement de Stokes (ou Stokes Shift) .
-
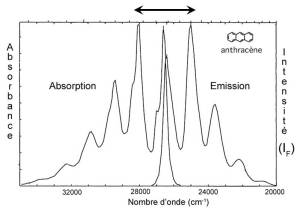
Le spectre d'émission de fluorescence est approximativement une image inversée (effet miroir) du spectre d'absorption. (L'effet « miroir » entre spectres d'excitation et d'émission n'est pas toujours observé : des dissimilitudes entre les deux spectres peuvent révéler l'existence de plusieurs formes de la molécule considérée, caractérisées par des longueurs d'onde d'absorption et/ou d'émission différentes).
Exemple :
|  spectres[Zoom...] |
-
Le spectre de fluorescence est le même quelques soient les conditions d'excitation. (Si excitation de E0 vers E1v0, E1v1, E1v4, E2v3 ...)
-
Très peu de molécules sont fluorescentes . Il existe de nombreuses transitions non radiatives pour lesquelles l'énergie absorbée est restituée sous forme de chaleur.