Lois de la pression osmotique
Les lois de l'osmose ont été établies empiriquement à partir de nombreuses études expérimentales et finalement exprimées sous forme théorique par Vant'Hoff.
Deux conditions préalables :
-
La membrane de l'osmomètre est strictement perméable, seule l'eau peut la traverser (vase poreux recouvert d'un gel de ferrocyanure de cuivre).
-
Les solutions sont diluées. On peut les considérer comme idéales.
Loi de Vant'Hoff.
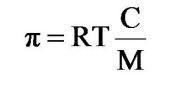 loi_vantHoff | π =pression osmotique en Pa (N/m2) C = concentration pondérale du soluté M = masse molaire T = température absolue R = constante des gaz parfaits |
La loi de Van't Hoff exprime le fait que la différence de pression exercée par une solution diluée contenant un certain nb de moles de soluté dans un volume donné et celle exercée par un solvant pur, est la même que celle qu'exercerait un gaz parfait contenant le même nombre de moles dans le même volume.
La pression osmotique donne des informations sur la masse molaire.
-
Dans le système MKSA : la pression osmotique est exprimée en Pascal (N/m2 )
-
Une osmole : pression. osmotique d'une solution contenant 1 mole de soluté/L (séparée de l'eau pure) à 20°C
