Mécanisme d'action
L'activité des β-lactames est variable selon la molécule considérée mais le mécanisme d'action est commun à toutes ces molécules, qui sont bactéricides par destruction de la paroi bactérienne. Les bactéries possèdent une structure particulière avec présence d'une paroi dont le constituant principal est le peptidoglycane.
Ce peptidoglycane forme un maillage qui entoure la bactérie et lui confère sa forme et sa rigidité. Il occupe une position différente selon que la bactérie est une bactérie à gram positif ou une bactérie à gram négatif. Mais dans tous les cas, ce peptidoglycane est étroitement lié aux processus de croissance et de division cellulaire de la bactérie.
Présenter différentes couches sur le diaporama.
Dans un premier temps, les lactames doivent traverser la paroi bactérienne, pour ensuite aller se fixer sur des protéines cibles de la membrane plasmique que l'on appelle les PLP = Protéines liant les Pénicillines. Ces PLP sont en fait des enzymes, transpeptidases, transglycosylases et carboxypeptidases, impliquées dans la synthèse du peptidoglycane.
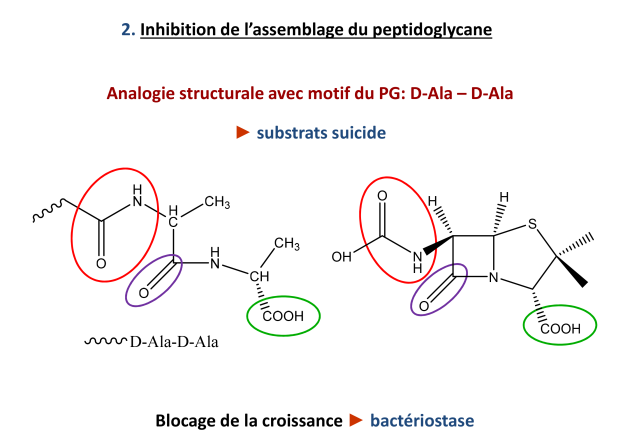
Les lactames se fixent très facilement sur ces PLP parce qu'elles possèdent une analogie structurale avec un constituant du peptidoglycane en formation qui est un substrat naturel de ces enzymes. Il s'agit du dipeptide D-alanyl-Dalanine : D-ala-D-ala.
(Détailler l'analogie structurale.)
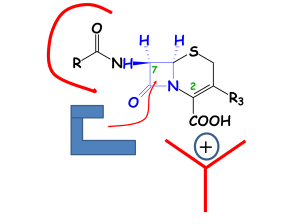
Les lactames vont donc se fixer sur ces protéines enzymatiques, vont subir une ouverture de cycle et bloquer le fonctionnement de ces enzymes. Elles agissent donc en substrat « suicide ». Ce mécanisme va permettre de bloquer la synthèse du peptidoglycane.
Dans un second temps, le peptidoglycane est alors dégradé sous l'action d'autolyses, ce qui finalement entraine la lyse bactérienne et donc un effet bactéricide.
Le nombre et la nature des PLP varient selon les espèces bactériennes considérées. Et l'affinité des différentes PLP n'est pas la même pour toute les molécules de lactame.
L'effet d'un b-lactame sera donc fonction de la bactérie considérée et de son affinité pour les PLP.
Chez les bactéries à Gram positif, où le PG constitue la paroi externe. Les molécules de β-lactames traversent facilement. En effet, le PG possède une structure réticulée qui ne constitue pas une véritable barrière. Les β-lactames peuvent donc atteindre facilement les PLP. Avec un bémol cependant, ceci est vrai tant que la teneur en lipides du PG n'est pas trop élevée (ce qui est le cas par exemple chez certains Streptomyces.)
En revanche, chez les bactéries à Gram négatif, la membrane externe constitue un obstacle au passage des b-lactames.
La traversée de cette membrane ne peut se faire que :
Par diffusion passive à travers la bicouche lipidique, pour les molécules hydrophobes. Mais dans le cas des b-lactames, nous avons affaire à des molécules fortement ionisées au pH physiologique et qui présentent donc un caratère hydrophile. (Ce passage n'est tout de même pas à exclure car les b-lactames seraient capables de franchir les lipopolysaccharides aux niveaux des ions Manganèse ou calcium.)
Par passage dans de fins canaux hydratés, formés par des protéines spécialisées, les porines, ceci pour les molécules hydrophiles. Cette voie est la voie principalement utilisée par les b-lactames. Le passage et donc l'activité des β-lactames seront donc conditionnés par le nombre de ces pores et leur perméabilité.
Lorsque la cible est atteinte, c'est-à-dire les PLP, la fixation des β-lactames se fait sur 3 sites principaux :
|