Mécanisme d'action
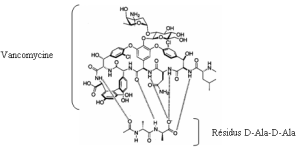
Les glycopeptides sont au même titre que les β--lactames des inhibiteurs de la synthèse du peptidoglycane de la paroi bactérienne. Leur action est toutefois différente. L'inhibition est due à l'affinité de ces antibiotiques pour l'extrémité (D- alanyl-D-alanine) des précurseurs du peptidoglycane. Ceux-ci, après avoir été synthétisés dans le cytoplasme bactérien, sont transportés à travers la membrane cytoplasmique pour finalement être branchés par des enzymes membranaires bactériennes (transglycosylases et transpeptidases) au peptidoglycane en cours d'élongation. La fixation du glycopeptide sur l'extrémité du précurseur empêche, par encombrement stérique, son branchement au peptidoglycane. Ces antibiotiques sont lentement bactéricides. Ils sont rarement bactéricides au bout de 24 heures et ne le deviennent qu'après 48 heures de contact avec les bactéries. Cette bactéricidie lente n'est pas expliquée. Une hypothèse est que l'action des inhibiteurs de la synthèse de la paroi (glycopeptides ou bêta-lactamines) active la libération d'autolysines qui dégradent la paroi, provoquant ainsi un suicide bactérien mais que du fait de leur taille et de l'encombrement stérique qu'ils provoquent, les glycopeptides gênent l'action de ces enzymes. |