1. Obtention du sulfate basique de quinine à partir de la poudre de Quinquina.
a) Principe
poudre de quinquina + débloquant (= chaux Ca(OH)2) + alcali (= soude NaOH)
extraction par le dichlorométhane
résidu solution organique
extraction en milieu aqueux acide
solution organique phase aqueuse
+ alcali ---> pH 6
(NaOH 10 % ---> pH 3.5)
(puis 5 % ---> pH 6)
sulfate basique de quinine
b) Extraction
But de l'extraction* : obtenir environ 150 mg de sulfate basique de quinine, compte tenu :
d'une teneur de l'écorce de quinquina rouge en alcaloïdes totaux de 5 à 8 % (prendre 5% pour les calculs), dont 30 à 60 % de quinine base (prendre 50% pour les calculs).
d'un taux de perte estimé à 50 % pour l'ensemble de l'extraction
*Mode opératoire :
Extraction solide liquide en milieu organique :
1) Mélanger à froid : poudre de quinquina + chaux (1/3 du poids de la poudre) + soude à approximativement 10% (m/v) jusqu'à consistance visqueuse.
2) Extraire par 2 fois 50 mL de dichlorométhane sous la hotte.
3) Filtrer et mesurer à l'éprouvette le surnageant V2.
4) En considérant Vo = 100 mL , V2 = volume récupéré, V1 (volume retenu) = Vo-V2,
a = Vo/V1 et n = nombre d'extractions, déterminer le rendement théorique global de l'extraction selon la formule suivante :
Extraction liquide-liquide en milieu aqueux acide :
5) Solvant extracteur : H2SO4 à 2 % en ampoule à décanter.
Soit un rapport de solvant B (H2S04)/A (dichlorométhane) = 0,1 pour chaque extraction et un coefficient de partage λ = 17. Combien faut-il faire d'extractions pour obtenir un rendement global de 0,95 ?
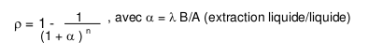
Déterminer le volume d'acide à utiliser en fonction du volume de dichlorométhane et du rapport de solvant.
Précipitation du sulfate basique de quinine :
6) Amener la solution acide à pH 6 (soude diluée à 10 %, à chaud : 50-60°C, pH-mètre). Laisser refroidir 24 H.
7) Observer les cristaux. Les isoler par filtration des eaux-mères et conserver les deux produits. Laver les cristaux à l'eau distillée, sécher.
c) Chromatographie liquide haute performance (C.L.H.P.)
Une démonstration d'identification des cristaux et des eaux mères de votre manipulation sera faite en travaux pratiques.
Conditions opératoires :
Colonne Macherey-Nagel EC 250X4,6 mm Nucléosil 100, 10 µm RP C18.
Phase mobile : formate d'ammonium (100 mM) / acide formique / acétonitrile 80 : 5 : 15 (v : v : v)
Débit : 1 mL /min, pression : env. 90 bars
Détecteur UV : 246 nm, atténuation : 0,1
Enregistreur à 0,5 cm/min
Seringue Hamilton 702SNR.
Solutions témoins :
sulfate basique de quinine, quinidine, cinchonine et cinchonidine à 1 mg/mL dans la phase mobile, puis diluées au 1/100. Injecter 3 µl de chaque solution.
Produits : cristaux : pointe de spatule dans 400 µl de solvant, injecter 10 µl.
eaux mères : 50 µl + 200 µl de solvant, injecter 10 µl.





