Synthèse et propriétés physico-chimiques
![]() SYNTHÈSE
SYNTHÈSE
L'ASPIRINE (ASA) est désignée sous diverses appellations chimiques (acide acétylsalicylique, acide 2-acétyloxybenzoïque). Classiquement, sa préparation comporte deux étapes :
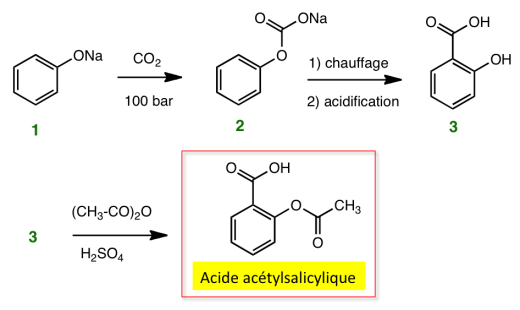
1ère étape : l'action du CO2 sous pression sur le phénate de sodium 1 conduit au carbonate de phényle et de sodium 2, qui par chauffage se transpose en salicylate de sodium (réaction de KOLBE-SCHMITT) ; l'acide salicylique 3 est obtenu par acidification.
2e étape : l'action de l'anhydride acétique sur l'acide salicylique conduit au dérivé O-acétylé.
![]() PROPRIÉTÉS PHYSICO-CHIMIQUES
PROPRIÉTÉS PHYSICO-CHIMIQUES
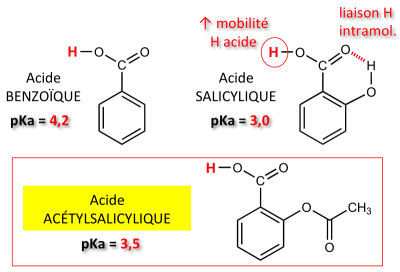
L'ASPIRINE (formule brute : C9H8O4, PM = 180,1) est une molécule assez lipophile (log P = 1,19), ce qui explique sa faible solubilité dans l'eau (à pH neutre, environ 3 g/L, à température ambiante). L'acidité de l'aspirine (pKa = 3,5) se situe à un niveau intermédiaire entre celle de l'acide benzoïque (pKa = 4,2) et celle de l'acide salicylique (pKa = 3,0).
![]() Commentaire
Commentaire
Le caractère fortement acide de l'acide salicylique s'explique par la présence du groupement phénol en ortho. L'hydroxyle phénolique est susceptible de participer à une liaison hydrogène intramoléculaire impliquant le carbonyle voisin. La dissociation acide de l'OH carboxylique est facilitée (l'augmentation du caractère acide, se traduit par un abaissement du pKa).
L'aspirine est un dérivé salicylé dans lequel le groupe phénol est bloqué par estérification : l'impossibilité de liaison H intramoléculaire explique donc l'acidité moins marquée de l'aspirine, comparativement à l'acide salicylique.
Remarque : À PROPOS DE LA STABILITÉ DE L'ASPIRINE
La stabilité de l'aspirine est conditionnée à la fois par le degré d'humidité, la température et le pH.
À l'état solide, l'ASA se présente sous la forme d'une poudre cristalline relativement stable en l'absence d'eau et à température ambiante.
Les solutions aqueuses possèdent une stabilité optimale pour un pH compris entre 2 et 3. La stabilité décroît rapidement avec l'augmentation du pH : l'hydrolyse libère de l'acide salicylique et de l'acide acétique (ou les anions correspondants dans le cas d'un milieu alcalin).

Toute préparation d'aspirine présentant une odeur vinaigrée (= acide acétique) doit être rejetée : ce signe révèle la présence conjointe d'acide salicylique dont la toxicité gastrique est importante !






