Equilibre de Donnan
-
Phénomène décrit pour la première fois par Donnan en 1911
-
Si l'on oppose à travers une membrane dialysante une solution de macromolécules ionisées M-Na+ à une solution aqueuse de Na+Cl- par exemple, les concentrations des ions diffusibles de part et d'autre de la membrane ne peuvent s'égaliser à cause de la présence de macromolécules chargées qui ne diffusent pas.
-
Il y a du côté des macromolécules un excès d'ions diffusibles, d'où une pression supérieure à la pression osmotique normale, cette nouvelle pression porte le nom de pression oncotique .
Les deux compartiments renferment une solution saline contenant de l'eau et des ions capables de traverser librement la membrane (ions diffusibles). L'équilibre est perturbé par la présence dans le compartiment 1 d'une macromolécule M chargée non diffusible. | 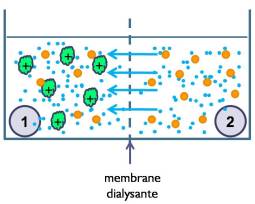 pression_oncotique |
REMARQUE : La macromolécule est introduite dans le compartiment 1 sous forme neutre, c'est à dire avec les contre-ions en quantité suffisante pour rendre l'ensemble {M+contre-ion} neutre ;
-
C1 et C2 sont respectivement les concentrations molaires des solutions 1 et 2. Du fait de la répartition asymétrique des ions de part et d'autre de la membrane, il existe une différence de potentiel appelé potentiel de Donnan (potentiel qui permet d'annuler le flux diffusif des ions).
Relation de Nernst :
-
Du fait du déséquilibre de concentration des ions, la pression osmotique est fortement réduite, c'est l'effet Donnan.
-
Lorsque l'équilibre est établi de part et d'autre de la membrane, la relation de Donnan est vérifiée :
[Na+]2 x [Cl-]2 = [Na+]1 x [Cl-]1
-
Le rapport de Donnan est défini par :
-
La neutralité électrique doit être respectée dans chacun des compartiments.
-
dans le compartiment 2 :
-
dans le compartiment 1 : (z étant le nombre de charges + portées par la macromolécule M)
or et
en remplaçant dans on obtient :
posons S étant la concentration de chacune des 2 espèces ionisées dans le compartiment 2
en réarrangeant (on multiplie par rd et on divise par [Na+]2 , on obtient une équation du second degré
cette équation du second degré a 2 racines dont seule la positive a une signification physique :
-
Remarques :
-
rd est généralement car Na+ et Cl- ne sont pas distribués de manière homogène dans les compartiment 1 et 2.
-
Le paramètre important dans cette équation est le rapport dans lequel z[M] représente la concentration en charges de la macromolécule et 2[S] la concentration totale en ions dans le compartiment 2.
-
Si la macromolécules est chargée + rd >0 et si la macromolécules est chargée - rd <0
Exemple d'une macromolécule avec une charge +10 rd
[M] =10-4 M , [NaCl]2 =50µM
10
20,05
[M] =10-5 M , [NaCl]2 =50µM
1
2,41
[M] =10-6 M , [NaCl]2 =50µM
0,1
1,1
[M] =10-5 M , [NaCl]2 =5mM
0,01
1,01
-
Pour faire disparaître l'effet Donnan, il faut augmenter la concentration en sel dissociable.
-
L'effet Donnan est important dans le cas de capillaires sanguins et lors de la dialyse rénale afin :
-
de contrôler les échanges salins
-
de minimiser la pression osmotique
-
d'éviter une forte migration d'eau à travers la membrane
-
