Structure
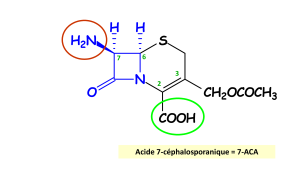
Comme nous l'avons vu dans le chapitre d'introduction, les céphalosporines possèdent toutes un squelette céphème, résultant de la condensation du noyau bêta-lactame et d'une dihydrothiazine. L'acide 7-aminocéphalosporanique, squelette de base de toutes les céphaloporines, se caractérise par la présence :
|
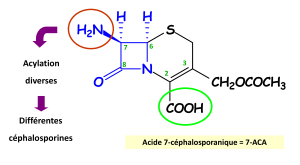
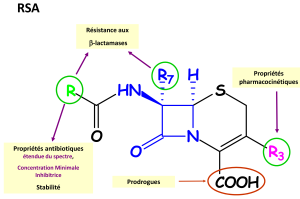
A partir du 7-ACA, les différentes céphalosporines se différencient par l'acylation de l'amine en position 7. Mais les modifications de structure porteront aussi sur d'autres sites des molécules. Ce squelette adopte, comme pour les pénicillines, une conformation en livre ouvert. |
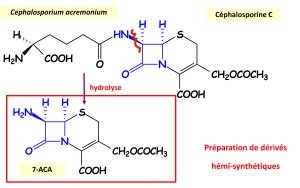
A ce jour, une seule céphalosporine naturelle garde un intérêt, il s'agit de la céphalosporine C, produit par fermentation de Cephalosporium acremonium. Après extraction, elle est hydrolysée en 7-ACA qui sera alors utilisé pour l'hémisynthèse des différentes céphalosporines utilisées en thérapeutique. Dès son isolement, la céphalosporine C a révélé une activité antibactérienne faible et a donc été soumise à de nombreuses modifications structurales, plus complexes que celles réalisées dans la classe des pénicillines. |
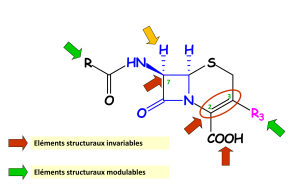
Ces modifications structurales respectent cependant trois éléments structuraux indispensables à l'activité antibactérienne, donc invariables, en plus du cycle bêta-lactame. Il s'agit :
Les modulations se feront donc principalement :
D'autres modifications permettent d'obtenir des molécules apparentées :
|
L'ensemble des modifications ne modifient ni le mécanisme d'action, ni la toxicité qui reste faible, ni le risque d'allergie bien réel. En revanche, ces modifications ont un retentissement sur d'autres paramètres, notamment :
Il est important de noter également, qu'il est possible de former des « pro-drogues » par estérification de l'acide carboxylique en position 2. Ces pro-drogues sont destinées à la voie orale. |