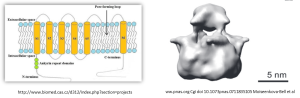
2.1.2 Les canaux TRP (Transient receptor potential)

Il existe une large diversité des canaux TRP répartis en 6 familles. Chaque canal a des fonctions spécifiques.
Les canaux TRP sont composés de 4 sous-unités. Chaque sous-unité est composée de 6 segments transmembranaires[1]. Les boucles entre les segments 5 et 6 de chaque sous-unité forment le pore (P).
La plupart des canaux TRP est activée par une voie protéine G[2] / PLC[3] ou tyrosine kinase[4]. Ils sont aussi sensibles à forces physiques (l'étirement comme le canal TRPV4) ou thermique (chaud/froid comme le canal TRPV1) et directement à de nombreuses molécules (comme le menthol pour TRPM8).
Enregistrement électrophysiologique de l'ouverture d'un canal TRP sensible à l'étirement mécanique (succion via une pipette) |
Leurs rôles physiologiques sont multiples :
-Rôle bien établi dans les neurones sensitifs (sensibles au pH, température, composés de plantes...)
-Rôle dans la prolifération
-Rôle dans la contraction.