Orbitales liantes et antiliantes
Question
En fait, je ne comprends rien à la notion d'orbitale antiliante. A quoi correspond-elle exactement et quel est son rôle (si tant est qu'elle en ait un) ?
Une orbitale atomique est une région de l'espace autour du noyau, dans laquelle il existe une grande probabilité de rencontrer un électron. Les orbitales atomiques sont les représentations graphiques des fonctions mathématiques solutions de l'équation de Schrödinger. L'orbitale s est une sphère autour du noyau. L'orbitale p correspond à 2 lobes plus ou moins en fuseau se touchant sur les "côtés" opposés du noyau. Dans une orbitale p, la probabilité de trouver un électron au niveau du noyau est nulle. On dit que le noyau est un point nodal. On parle aussi de node. Dans ces orbitales p, la fonction mathématique, qui correspond aux orbitales, change de signe au niveau du noyau et on désigne les régions d'une orbitale séparée par un node par des signes + et -. | 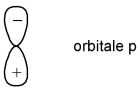 Question 4 ressource 2 |
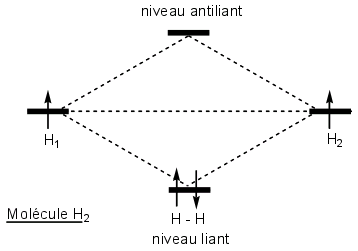
Il se forme une liaison covalente par recouvrement de deux orbitales atomiques OA, chacune venant d’un atome. Ce recouvrement fournit une nouvelle orbitale = orbitale moléculaire OM qui englobe les deux atomes. L'interaction des 2 OA crée 2 OM.
Si les orbitales de même signe se recouvrent (addition des fonctions représentant chaque OA), il en résulte une orbitale liante dans laquelle la densité électronique entre les atomes est grande et qui donc possède une énergie plus basse que celle des OA individuelles.
Si ce sont des orbitales de signe opposé qui se recouvrent (soustraction des fonctions représentant chaque OA), il y a formation d'une orbitale antiliante d'énergie plus élevée que les OA de départ. La densité électronique est nulle entre les atomes.
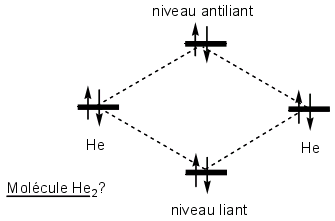
L'orbitale 1s de l'hélium est occupée par deux électrons. Si He2 existe, les 2 OA de l'hélium donnent 2 OM. Il faut placer 4 électrons sur 2 orbitales moléculaires (2 par orbitale). On a donc 2 électrons dans une orbitale liante mais aussi 2 électrons dans une orbitale antiliante.... électrons dans une orbitale antiliante.... impossible... La molécule He2 moins stable que les 2 He séparés, n'existe pas.
Dans une orbitale moléculaire, il y a deux électrons, jamais plus. n OA donnent n OM. Si vous reprenez le cas du butadiène, 4 OA → 4 OM, deux liantes et 2 antiliantes.
