Liaison chimique délocalisée
Question
Ma question concerne le butadiène et sa stabilisation. En fait je comprends l’énergie de résonance, mais dans le calcul du cours qui compare l’énergie de 4 électrons dans un système conjugué à celle de 4 électrons dans un système non conjugué, je ne comprends pas du tout ce que représente les coefficients α et β (une énergie je suppose, mais qui vient d’où ?)
De plus il me semblait que dans ce genre de diagramme on mettait 2 électrons par OM et 4 par et . Ce qui n'est effectivement pas logique vu qu'une liaison n'est formée il me semble que de 2 électrons. Du coup je ne sais plus trop quoi penser !!
Voici un texte tiré d’un livre numérisé par Google qui concerne la liaison chimique.
Liaison chimique Maurice Griffé. C'est le chapitre 7.
Deux atomes sont liés lorsque, à une distance bien précise l'un de l'autre, ils sont dans une situation plus stable (de plus basse énergie) qu'à une distance plus longue ou plus courte. L'énergie de la liaison chimique en chimie organique, est plus faible que si les deux atomes étaient plus proches ou plus éloignés.
Dans la molécule d'hydrogène, la longueur de la liaison est égale à 0,74Å.
La courbe ci-dessous représente l'énergie potentielle d'une liaison en fonction de la distance interatomique. Cette courbe passe par un minimum correspondant, en abscisses, à la longueur de la liaison.
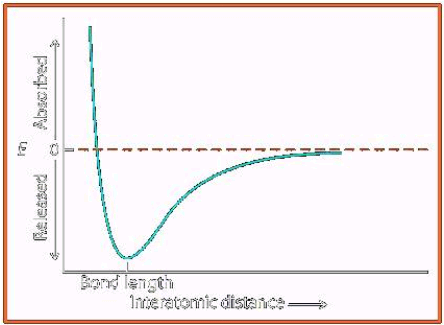
Ce minimum d'énergie correspond à un équilibre entre deux effets opposés:
-
l'attraction à grande distance
-
la répulsion à faible distance.
Les deux atomes, bien qu'électriquement neutres, sont attirés l'un vers l'autre. Dans un atome, les localisations des charges positives et négatives sont différentes: les charges positives (protons) sont localisées dans le noyau tandis que la répartition des électrons autour du noyau est diffuse.
Quand il y a excès des attractions protons-électrons sur les répulsions entre protons et entre électrons, les deux atomes se rapprochent et la liaison se forme. Jusqu'à une certaine distance, l'attraction est inversement proportionnelle au carré de la distance séparant les deux atomes: l'énergie du système diminue donc lorsque les deux atomes se rapprochent.
A faible distance, les noyaux atomiques se repoussent. Cette répulsion est négligeable quand la distance entre les atomes est supérieure à la somme des rayons atomiques, mais elle devient rapidement prépondérante pour des distances plus faibles.
Une orbitale atomique est une fonction mathématique qui détermine la région de l’espace où la probabilité de trouver un électron autour du noyau est élevée (95%).
Lorsque deux orbitales atomiques se recouvrent, il y a formation de deux orbitales moléculaires: une orbitale moléculaire liante d'énergie plus basse que celle des deux atomes de départ et une orbitale moléculaire antiliante d'énergie plus élevée que celle des deux atomes de départ. Ceci est valable quelque soit l'orbitale atomique: s ou p, par contre le recouvrement de deux orbitales s est axial (liaison ) alors que celui de deux orbitales p est latéral (liaison ).
Pour la molécule de dihydrogène, l'orbitale moléculaire liante contient deux électrons, et l'antiliante est vide.
Les fonctions qui représentent les orbitales moléculaires sont obtenues par addition ou par soustraction des fonctions correspondant à chaque orbitale atomique (addition pour les orbitales liantes et soustraction pour les orbitales antiliantes).
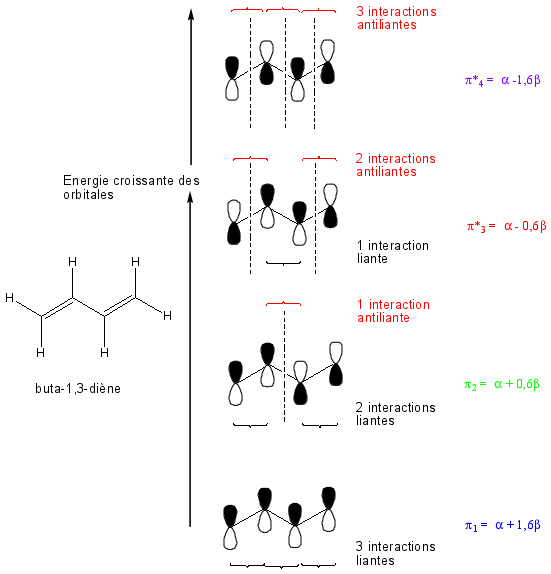
Les doubles liaisons du buta-1,3-diène CH2=CH-CH=CH2 sont "conjuguées" puisqu'il y a alternance de deux liaisons doubles et d’une liaison simple. Par le calcul, on peut démontrer que le butadiène, avec ses doubles liaisons conjuguées, possède une énergie interne plus basse que celle d'un produit avec un même nombre d'électrons mais non conjugués.
Toujours dans le cas du buta-1,3-diène, les quatre orbitales atomiques p conduisent à la formation de quatre orbitales moléculaires : deux liantes , π, et deux antiliantes et . Les termes α ou β représentent l'énergie d'un électron. Ils sont déterminés à partir de calculs. Ce sont des données mathématiques. Le terme β est négatif.
L'orbitale antiliante , la moins stable, a le niveau d'énergie le plus élevé = α - 1,6β. Ensuite = α - 0,6β puis les deux orbitales liantes = α + 0.6β et = α + 1.6β
Pour faire apparaître l'énergie de résonance, il suffit de comparer l'énergie des quatre électrons à l'intérieur de ce système conjugué à celle de quatre électrons dans un système non conjugué (deux molécules d'éthylène).
Comme il ne peut y avoir que deux électrons dans une orbitale moléculaire, il y a deux électrons dans et deux dans .
L'énergie de ces quatre électrons est donc de 2(α+1,6β) + 2(α+0.6β)= 4α + 4,4β
Pour un système de même nombre d'électrons (4) mais non conjugués on aurait: quatre fois l'énergie d'un électron dans une orbitale de l'éthylène (voir cours) soit 4(α+β) = 4α + 4β
La différence d'énergie est donc (4α+ 4,4β) - (4α+ 4β) = +0,4β
Il y a abaissement d'énergie car β est négatif. La conjugaison des doubles liaisons abaisse l'énergie interne d'un produit; elle augmente donc sa stabilité.
