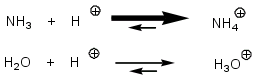
Comparaison basicité
Question
Ce matin en TD, je n’ai pas compris la comparaison de la basicité de NH3 et de H2O.
La basicité de l’ammoniac et celle de l’eau sont dues à la présence de doublets non liants sur l’azote et sur l’oxygène.
Pour comparer des bases :
-
il faut écrire les équations qui traduisent le caractère basique des produits.
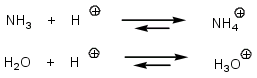
NH4+ et H3O+ sont les acides conjugués des bases NH3 et H2O.
-
il faut comparer la stabilité des deux acides conjugués et tenir ce raisonnement :
-
plus l'acide conjugué est stable
-
plus l'équilibre est déplacé vers la droite
-
plus il y a alors fixation de protons
-
plus la base est forte
-
-
NH4+et H3O+: les atomes d'oxygène et d'azote sont entourés tous les deux de 8 électrons, ils sont stables (règle de l'octet). Par contre, O, plus électronégatif que N, supporte moins bien une charge positive, H3O+ est donc moins stable que NH4+, l'équilibre, dans le cas de l'eau, est moins déplacé vers la droite, il y a moins de fixation de H+ et donc H2O est moins basique que NH3.
On peut rectifier les flèches du schéma :