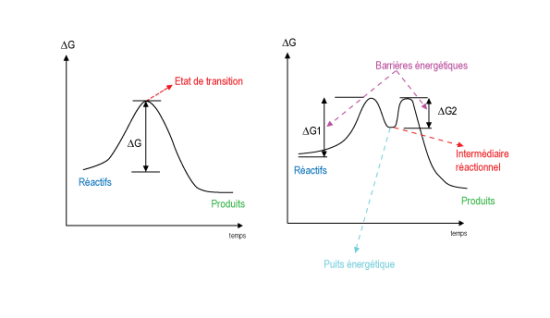
Etat de transition – Intermédiaire réactionnel
Question
Est-ce qu’il y a une différence entre état de transition et intermédiaire réactionnel ou est-ce que c’est la même chose?
Si vous tracez le diagramme énergétique d’une réaction en UNE étape (SN2), vous avez une courbe en cloche avec un maximum. Ce maximum correspond à l’état de transition. Dans le cas d’une SN2, le nucléophile attaque le carbone siège de la substitution. Au fur à mesure qu’il approche de ce carbone, le nucléofuge s’éloigne et vous arrivez à un état de transition où le nucléophile est déjà un peu fixé et le nucléofuge un peu éliminé. Cet état de transition est parfaitement instable. Il correspond à un complexe activé non isolable et n’est pas observable par des méthodes physiques. Il a un niveau d’énergie élevé et pour l’atteindre, il faut fournir une certaine quantité d’énergie (énergie d’activation), le plus souvent sous forme de chaleur.
Si maintenant vous tracez le diagramme énergétique d’une réaction en DEUX étapes (SN1), vous avez une courbe « à deux bosses » séparées par un minimum plus ou moins profond (puits énergétique). Ce minimum représente l’intermédiaire réactionnel. Il a une durée de vie très courte mais il peut être observé par des méthodes physiques. C’est le cation stable par lequel vous passez lorsque vous faites votre réaction.