Alcools – Acidité
Question
Pourriez-vous m'expliquer comment fait-on pour montrer (effets inductifs) qu'un produit est plus acide qu'un autre (ex: l'eau et un alcool) ?
Quand vous avez à comparer l'acidité de deux produits, il faut toujours commencer par écrire l'équation qui traduit le caractère acide.
Par exemple, comme vous le demandez: un alcool ROH et l'eau.
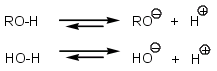
ROH et HOH sont les acides et RO- et HO-, les bases conjuguées. Plus la base conjuguée est stable, plus l'équilibre est déplacé vers la droite, plus il y a en même temps libération de protons, plus le produit étudié est acide.
La seule différence entre RO- et HO- c'est R et H. R est inducteur (+I). Il enrichit en électrons l'oxygène qui est déjà chargé négativement. Dans l'alcoolate, R déstabilise donc la charge négative.
Avec HO-, pas d'effet (+I) pour H. Donc HO- est plus stable que RO-.
Si on raisonne à partir de l'eau, la base conjuguée HO- est plus stable que RO-, l'équilibre est plus déplacé vers la droite......... donc l'eau est plus acide que l'alcool.
On aurait la même chose, mais dans l'autre sens, c'est-à-dire avec un effet -I, pour ClCH2-COOH et CH3-COOH.
Par son effet (-I), Cl augmente la charge de l'hydrogène du carboxyle -COOH, et l'acide chloré sera plus acide que celui qui ne l'est pas:
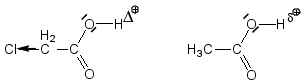
Si on raisonne sur la stabilité des bases conjuguées, ClCH2-COO- et CH3-COO-, on constate que le chlore par son effet –I diminue la charge (-) du carboxylate (dispersion du doublet électronique) en augmentant de ce fait sa stabilité. L'acide chloré est donc plus acide.
Question
Comment savoir qu’un alcool tertiaire est moins acide qu’un alcool primaire ? Le pKa sera-t-il plus faible ?
Les trois chaînes alkyles d'un alcool tertiaire, par leurs effets +I, augmentent la densité électronique de l'hydrogène de la liaison O-H et diminuent sa charge . Dans un alcool primaire, il n'y a qu'une chaîne alkyle ; l'enrichissement en densité électronique de H est moindre que précédemment et donc la charge portée par l'hydrogène d'un alcool primaire est plus importante que celle portée par un alcool tertiaire. L'alcool primaire est plus acide qu'un alcool tertiaire.

On peut également aboutir à ce résultat en résonnant sur les stabilités des bases conjuguées des alcools.
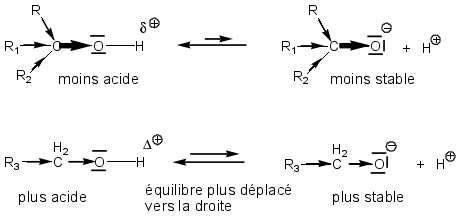
Les trois effets +I des trois chaînes alkyles déstabilisent l’alcoolate tertiaire en augmentant fortement la densité électronique de l’oxygène. L’alcoolate primaire, avec un seul effet +I est plus stable ; l’équilibre acido-basique le concernant sera plus déplacé vers la droite que pour l’alcoolate tertiaire, il y aura donc plus formation de protons, donc l’alcool primaire est plus acide que le tertiaire.
Concernant les pKa, celui du méthanol est égal à 15, celui du nbutanol à 16 et celui du tertiobutanol à 19.
Moins une base est stable plus elle est forte car plus vite elle réagit avec un proton pour aboutir à un composé stable. L’alcoolate tertiaire est une base plus forte que l’alcoolate primaire.
Question
Je n’ai pas compris pourquoi le méthylate est une base moins forte que le tertiobutylate.
Le caractère basique des alcoolates est dû aux doublets électroniques présents sur l’oxygène. Plus la densité électronique est élevée, moins l’alcoolate est stable, plus il arrachera facilement un proton pour se stabiliser, plus il est fort.
Dans le tertiobutylate ou butanolate les effets +I des trois groupements méthyle augmentent la densité électronique de l'oxygène. Le tertiobutanolate est donc une base forte, plus forte que le méthanolate où, en raison de l'existence d'un seul effet +I, la densité électronique de l'oxygène est plus faible.
