La variation d'énergie libre d'une réaction catalysée par une enzyme
Une réaction chimique n'est possible que si les molécules qui doivent réagir entre elles (A avec B) sont activées, c'est-à-dire portées à un niveau énergétique supérieur. L'énergie correspondante est appelée énergie d'activation ; c'est le différentiel d'énergie libre entre l'état initial et l'état activé. La simple augmentation de température peut fournir cette énergie d'activation en favorisant les rencontres entre molécules (agitation moléculaire), principe très utilisé en chimie organique.
Le rôle d'un catalyseur est d'abaisser le niveau de l'énergie d'activation. L'enzyme est un biocatalyseur particulièrement efficace en fragmentant cette barrière d'énergie : elle fractionne la réaction en étapes intermédiaires correspondant à des faibles variations d'énergie. On dit qu'elle stabilise l' « état de transition », c'est pourquoi on parle aussi de fractionnement de l'énergie de transition. On peut comparer ces deux types de catalyseurs au passage d'un torrent de montagne par un promeneur ; soit il saute d'une berge à l'autre, dépensant d'un coup une grande quantité d'énergie, soit il trouve un gué formé de pierres rapprochées, il pourra traverser aisément par petits sauts, de pierre en pierre, en dépensant moins d'énergie et de façon fractionnée ; et si les deux berges sont très éloignées, il n'y a bien sûr pas d'autre solution que de trouver un gué.
Dans le cas d'une réaction exergonique, le niveau énergétique final est inférieur à celui de l'état initial avant activation. La berge d'arrivée est plus basse que celle de départ, le saut sera plus facile que dans la situation inverse, qu'il y ait un gué ou non. Donc, l'enzyme ne modifie pas le sens thermodynamiquement favorable de la réaction.
Dans les cellules et les milieux biologiques extracellulaires, les molécules sont peu concentrées, souvent à la milli- ou micro-mole.L-1 ;
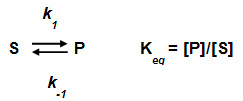
ÄG = ÄG° + RTLn([P]/[S])
à l'équilibre, ÄG = 0 donc :
ÄG° = - RTLnKeq = - RTLn([P]/[S])
ÄG° = variation d'énergie libre standard
+ E : v = k1.[S] avec k1 x 105 à 1017 par rapport à une réaction non catalysée par une enzyme (E).
