Exercice 2
On désire comparer les paramètres enzymatiques de deux phosphatases (PA), la phosphatase alcaline (PAL) et la phosphatase acide (PAC), purifiées à partir du foie de rat. L'étude comparée est menée sur les enzymes partiellement purifiées ; selon les résultats d'une analyse par électrophorèse, la PAL est pure à 50 % et la PAC à 80 %. Les activités enzymatiques de ces préparations sont déterminées sur le même substrat synthétique, le paranitrophénylphosphate (PNPP), en respectant les conditions de mesure de vitesses initiales, et selon le schéma réactionnel suivant :
Incubation pendant 10 minutes, puis arrêt de la réaction par un tampon pH 10,5 et lecture au spectrophotomètre à 405 nm ; la quantité de paranitrophénol (PNP) formé est lue sur une gamme d'étalonnage établie dans les mêmes conditions.
Question
1- Quelle condition particulière doit être respectée pour mesurer sur le même substrat les activités des deux PA ?
Ces deux enzymes présentent des pH optimums différents ; on doit se placer en milieu acide pour déterminer l'activité de la PAC (en réalité vers 5,5), et en milieu alcalin (vers 8,6) pour déterminer celle de la PAL. Après incubation pendant 10 min dans le milieu tamponné adéquat, la réaction est arrêtée par franche alcalinisation (pH = 10,5), pH qui ne correspond à aucune des deux PA.
Question
2- Pourquoi arrête-t-on la réaction avec un tampon très alcalin ?
Outre ne plus permettre l'activité des PA, l'alcalinisation du milieu ionise le paranitrophénol (PNP) produit : il devient un phénate par perte d'un proton (pKa ≈ 10). Le fait que le PNP soit substitué en position para par un groupement nitré, va enclencher une délocalisation des électrons faisant passer le phénate sous forme quinonique, forme conjuguée qui absorbe fortement entre 405 et 415 nm, propriété que ne présente pas le substrat PNPP (le phénol y est bloqué par l'ester phosphorique)(voir Cours de Chimie Organique).
Question
3- La réaction serait-elle possible avec l'orthonitrophénylphosphate (ONPP) plutôt qu'avec le PNPP ?
Les PAC et PAL catalyseraient tout aussi bien son hydrolyse, mais en libérant de l'orthonitrophénol (ONP), qui à pH = 10,5 ne présente pas de forme quinonique (la position ortho ne le permet pas). En conséquence, l'ONP a un coefficient d'absorption molaire (ε) à 410 nm beaucoup plus faible que le PNP, qui sera ainsi préféré (voir plus loin pour ε).
Question
4- Comment mesure-t-on l'activité enzymatique ?
On mesure la quantité de produit apparu (le PNP), en utilisant ses propriétés spectrales (son absorbance à 410 nm), et donc en appliquant la loi de Beer-Lambert (voir Cours de Physique : « absorption de la lumière par une solution »):
A = logI0/I = C.ε.l
I0 : intensité de la lumière incidente ; I : intensité de la lumière transmise
A : absorbance mesurée à la longueur d'onde choisie, ici à 410 nm (comme A = logI0/I, elle n'a pas d'unité)
C : concentration molaire (en mole.L-1), ici celle du PNP (CPNP)
ε : coefficient d'absorption molaire (en cm-1.mole-1. L), ici celui du PNP à 410 nm (obtenu indirectement par la lecture sur la gamme d'étalonnage)
l : longueur de la cuve de lecture (en cm, par exemple 1 cm)
Et donc, puisque les conditions de mesure d'une vitesse initiale sont respectées :
v0 = ΔQPNP/Δt = ΔA.V/Δt.ε.l avec QPNP = CPNP.V = A.V/ε.l
V étant le volume de la mesure de CPNP. Bien sûr, si la préparation de PA est apportée sous un plus faible volume au milieu réactionnel, il faut tenir compte de la dilution dans le calcul final de l'activité.
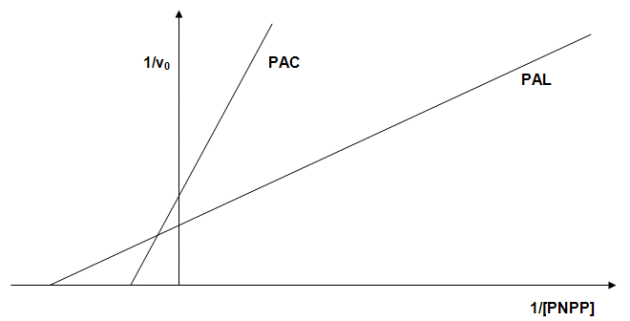
L'expérience de Michaelis est reproduite en faisant varier la concentration de substrat (PNPP), et l'on obtient les résultats suivants présentés sous forme de graphe de Lineweaver-Burk :
Question
5- Vis-à-vis de quelle PA le PNPP est-il le plus affin ?
Dans le graphe de Lineweaver-Burk, on peut lire la valeur de Km sur l'axe des abscisses au point d'intersection avec la droite expérimentale, en fait -1/Km. Donc plus le point d'intersection est proche de zéro plus la Km est grande donc plus l'affinité est faible : l'affinité du PNPP est donc plus grande pour la PAL que pour la PAC (environ d'un facteur 3).
Question
6- Quels auraient été les Km si les PA avaient été purifiées totalement ?
Les Km auraient été les mêmes puisque ce paramètre caractérise un substrat pour une enzyme ; c'est une constante enzymatique.
Question
7- Peut-on comparer les Vm ? Sinon pourquoi ? Comment calcule-t-on la constante catalytique ?
Les points d'intersection de l'axe des ordonnées avec les droites expérimentales sont différents pour les deux PA ; on pourrait penser que leurs Vm sont différentes. Mais, ces enzymes ne sont pas pures ; il est donc difficile de les comparer à ce niveau. Néanmoins, la PAL semble plus active (Vm plus élevée), mais elle est moins pure que la PAC (50 % pour la première contre 80 % pour la seconde). En extrapolant en enzyme pure, la PAL aurait une Vm environ deux fois plus grande que la PAC, et l'efficacité de la PAL exprimée en Vm/Km serait beaucoup plus élevée puisque sa Km est plus faible.
Quant au calcul de la constante catalytique kcat, il nécessite de connaître la concentration en enzyme totale [ET] ; la kcat peut alors être calculée selon :
Si v0 = kcat.[E] alors Vm = kcat.[ET] donc kcat = Vm.[ET]-1
Pour connaître la concentration molaire de l'enzyme, il faut sa masse moléculaire ; en effet le plus souvent on a dosé l'enzyme purifiée comme une protéine et le résultat est donné en g.L-1. En divisant par la masse moléculaire, on aura la concentration molaire en enzyme pure, et l'on pourra comparer les kcat des deux PA et leurs efficacités catalytiques (kcat/Km).
