Exercice 6
L'aspartate-transcarbamylase (ATCase) est une enzyme régulant la voie de synthèse des nucléotides pyrimidiques. Elle catalyse la carbamylation du groupement α-aminé de l'aspartate par le carbamylphosphate, première étape de cette voie de biosynthèse. L'aspartate et le carbamyl-phosphate sont les deux substrats et proviennent du métabolisme cellulaire ; les deux produits sont le carbamyl-aspartate et le phosphate. La réaction est nettement exergonique par la rupture d'une liaison riche en énergie, celle du carbamyl lié au phosphate ; du phosphate inorganique est libéré (Pi) :
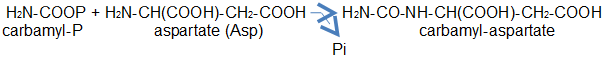
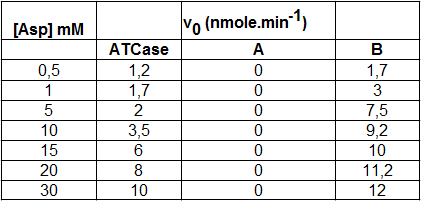
D'un point de vue structural, l'ATCase native est oligomérique, avec 12 sous-unités dont il existe deux types, A de 17 kDa et B de 35 kDa ; les sous-unités A sont associées en dimères (A2) et les sous-unités B en trimères (B3). L'ATCase entière résulte de l'association de 3 A2 avec 2 B3, faisant un Mr totale de (6 x 17) + (6 x 35) = 102 + 210 = 312 kDa, masse vérifié par sédimentation à l'équilibre. On peut dissocier les sous-unités A des sous-unités B en traitant l'enzyme entière par un réactif qui rompt les liaisons métalliques (ponts Zn2+) qui les réunissent ; les sous-unités A et B peuvent ensuite être séparées par chromatographie d'exclusion stérique. Des expériences d'enzymologie ont été réalisées sur l'enzyme entière et sur A et B séparées ; pour cela on a utilisé un essai enzymatique qui permet de mesurer des vitesses initiales (v0) sur toute la gamme des [Asp] utilisées, la [carmabyl-P] étant en excès (elle n'est donc pas un facteur limitant). On a obtenu les résultats suivants :
Question
Que peut-on conclure des résultats de ce tableau sur la nature des sous-unités A et B ?
La sous-unité A ne semble pas active, puisque que quelle soit la concentration d'aspartate, on ne trouve pas d'activité catalytique. Par contre, la sous-unité porte une activité catalytique puisque les v0 augmentent avec la concentration du substrat aspartate.
Question
Donnez la Vm pour l'Asp de la sous-unité catalytique. Calculez sa Km pour l'Asp après avoir vérifié que cette sous-unité est bien michaelienne pour l'Asp.
B est sans aucun doute la sous-unité catalytique (il y en a 6 dans l'ATCase entière). La Vm est proche de 12 nmoles.min-1. On peut vérifier que la sous-unité B est michaelienne encore en faisant des calculs à partir des valeurs du tableau :
Si [S] = 1 alors v0 = 3 et Km = 1(12/3 - 1) = 3 mM
Si [S] = 15 alors v0 = 10 et Km = 15(12/10 - 1) = 3 mM
C'est vrai aussi pour les autres concentrations de S. Donc la Km ne dépend pas de S et est égale à 3 mM ; la sous-unité B est bien michaelienne pour l'aspartate.
Question
L'ATCase entière (native) est-elle michaelienne ?
En refaisant ces calculs pour l'ATCase entière, on trouve une Kmapp qui varie beaucoup en fonction de la concentration d'aspartate. De même, s'il on trace le graphe v0 = f([Asp]), on voit une courbe sigmoïdale. Donc l'enzyme native est allostérique ; elle est formée de 6 sous-unités B catalytiques et l'on peut présumer que les 6 sous-unités A sont régulatrices, car lorsque l'on sépare les sous-unités B des sous-unités A, les premières deviennent michaeliennes. C'est donc la structure quaternaire qui porte l'allostérie, les sous-unités A y participant en modifiant les propriétés enzymatiques de B.
