PARTIE 1 - Simulation du comportement d'une enzyme michaelienne
SIMULATIONS 1, 2 et 3 : Notion de vitesse initiale - Effet de la concentration de substrat sur la vitesse de la réaction catalysée par une enzyme
Comme dans les travaux originaux de Michaelis et Menten publiés en 1913, nous fixons trois conditions d'étude :
Condition 1 : Considérons une réaction simple incriminant la transformation d'un seul substrat (S) en un seul produit (P) :
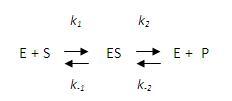
La première étape, la liaison de S sur E, permet la formation du complexe binaire ES ; elle dépend des constantes de vitesse (constantes cinétiques) k1 (constante aller) et k-1 (constante retour). La deuxième étape, la décomposition de ES, permet la libération du produit ; elle dépend des constantes de vitesse k2 (constante aller) et k-2 (constante retour).
Condition 2 : La première étape est beaucoup plus rapide que la seconde ; la vitesse de décomposition de ES étant souvent le facteur limitant d'une réaction catalysée par une enzyme, cette deuxième condition est généralement obtenue.
Condition 3 : La concentration de S est grande devant celle de E (rappelons que cette dernière est souvent très faible in vivo, ce qu'on peut facilement reproduire in vitro). Ainsi la réaction de retour est très improbable quelle que soit la thermodynamique de la réaction :
V0 = dP/dt = - dS/dt = k2.[ES] - k-2.[E].[P]
peut se simplifier en V0 = k2.[ES] tant que la réaction inverse reste négligeable (k-2 ≈ 0).
Cette condition expérimentale est nécessaire à la mesure d'une vitesse initiale (cinétique d'ordre 0).
