Exercice 5
On a purifié à l'homogénéité électrophorétique une enzyme cardiaque (EC) dont on connaît la structure quaternaire : EC est formée de 4 sous-unités qui sont de 2 types, A (40 kDa) et B (60 kDa). La formule de l'enzyme entière est 2A+2B avec une Mr de 200 kDa ; les sous-unités sont reliées entre elles uniquement par des liaisons faibles. On désire maintenant vérifier si l'enzyme est bien michaelienne ; pour cela on a reproduit l'expérience de Michaelis en utilisant le substrat S de EC et un essai enzymatique permettant de mesurer des vitesses initiales (v0) sur toute la gamme des [S] utilisées. On a obtenu les résultats suivants :
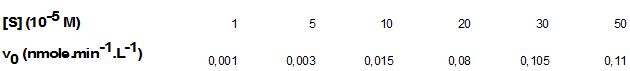
Dans une deuxième série d'expériences, on a ajouté un composé C à la solution d'enzyme EC et on a remesuré les activités enzymatique en fonction de [S]. On a obtenu ces nouveaux résultats :
Question
EC est-elle une enzyme michaelienne? Sinon pourquoi ?
Pour le savoir, on peut calculer la Km (constante de Michaelis-Menten) pour plusieurs concentrations de substrats ; si l'enzyme est michaelienne, on doit trouver la même valeur. On a besoin auparavant de déterminer la Vm ; selon le tableau, elle est proche de 0,11 nmole.min-1.L-1. Essayons de faire ces calculs, après avoir rappelé l'équation de Michaelis-Menten et en omettant les unités :
v0 = Vm.S/(Km + S) donc Km = [S](Vm/v0 - 1)
Si [S] = 5 alors v0 = 0,003 et Km = 5(0,11/0,003 - 1) = 178,3.10-5 M
Si [S] = 10 alors v0 = 0,015 et Km = 10(0,11/0,015 - 1) = 63,3.10-5 M
Si [S] = 20 alors v0 = 0,08 et Km = 20(0,11/0,08 - 1) = 7,5.10-5 M
Donc la Km varie beaucoup avec la concentration de substrat, elle diminue drastiquement avec elle, donc l'affinité augmente fortement quand la concentration de S augmente, même si c'est de peu (x 1,5 à 5 dans le tableau). C'est caractéristique d'un effet allostérique ou de coopération induite par le substrat. Donc l'enzyme EC n'est pas michaelienne, mais allostérique.
Question
Quel est la nature du composé C ?
On peut refaire les mêmes calculs en présence ce C :
Si [S] = 5 alors v0 = 0,07 et Kmapp = 5(0,11/0,07 - 1) = 2,86.10-5 M
Si [S] = 10 alors v0 = 0,09 et Kmapp = 10(0,11/0,09 - 1) = 2,22.10-5 M
Si [S] = 20 alors v0 = 0,105 et Kmapp = 20(0,11/0,105 - 1) = 2.10-5 M
Les Kmapp sont beaucoup moins variables que sans inhibiteur (ils varient entre 2 et 2,8.10-5 M), et toujours en diminuant ; on peut parler d'une courbe pseudo-hyperbolique et EC est devenue pseudo-michaelienne. Ces effets sont caractéristiques d'un activation allostérique ; donc C est un activateur allostérique de l'enzyme EC.
Question
Comment nomme-t-on ces phénomènes ?
- Le substrat provoque des effets homotropes, c'est-à-dire qu'il induit une modification conformationnelle qui favorise sa liaison dans le site actif. Dans le modèle RT (R = état restreint, T = état tendu), il présente une affinité plus forte pour l'état T et va déplacer l'équilibre conformationnel en faveur de T. Quand tout R est transformé en T, on obtient la Vm (grande concentration de S). Quand la moitié est transformée, on peut mesurer un K0,5 (constante de l'équilibre conformationnel).
- L'activateur allostérique provoque des effets hétérotropes (induits par un composé autre que le substrat). Il stabilise l'état T, donc l'état le plus affin pour S, et d'autant plus que l'activateur est plus concentré ; l'enzyme apparaît michaelienne (en fait pseudo-michaelienne).
Ces effets interviennent tous deux dans les régulations des métabolismes.

