Question 22
Question
Qu'est-ce qui caractérise I1 ? Et I2 ? Comment s'appellent ces deux types d'inhibition ? Comment calculez-vous le Ki de ces inhibiteurs?
I1 augmente la pente de la droite de Lineweaver-Burk, mais les droites avec ou sans inhibiteur se croisent toutes sur l'axe des y au point 1/Vm (courbes vertes) ; donc cet inhibiteur ne modifie pas la Vm. Par contre, les droites coupent l'axe des x en des points donnant -1/Km (on peut mesurer des Km apparentes de 5 µM avec I1 et 7,1 µM avec 2I1, pour 3 µM sans inhibiteur). Il s'agit bien d'un inhibiteur compétitif, qu'on appelle aussi inhibiteur de type K (« touche la Km »). On peut calculer Ki par :
Km apparente = Km.(1 + [I]/Ki)
I2 augmente aussi la pente de la droite de Lineweaver-Burk, mais les droites avec ou sans inhibiteur se croisent toutes cette fois sur l'axe des y au point -1/Km ; donc cet inhibiteur ne modifie pas la Km. Par contre, les droites coupent l'axe des y en des points donnant 1/Vm (on peut mesurer des Vm apparentes de 13 nmoles.s-1 avec I2 et 10 nmoles.s-1 avec 2I2, pour 20 nmoles.s-1 sans inhibiteur). Il s'agit bien d'un inhibiteur non compétitif, qu'on appelle aussi inhibiteur de type V (« touche la Vm »). On peut calculer Ki par :
Vm apparente = Vm/(1 + [I]/Ki)
Complément :
L'inhibiteur compétitif possède des analogies de structure avec le substrat, ainsi il pourra prendre sa place dans le site actif, empêchant l'acte catalytique de se dérouler, d'où les v0 plus faibles. Mais en augmentant la concentration de substrat on déplace l'inhibiteur selon la loi d'action de masse et on peut retrouver la Vm à très forte concentration de S, car il n'y a plus d'inhibiteur fixé dans le site actif. On a donc une réelle compétition entre le substrat et l'inhibiteur pour la liaison dans le site actif. L'inhibiteur compétitif est un pseudo-substrat ; il prend sa place mais ne subit pas l'acte catalytique. On peut proposer le schéma suivant :
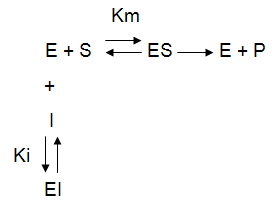
L'inhibiteur non compétitif ne ressemble pas au substrat et ne peut donc pas prendre sa place dans le site actif. Il se fixe ailleurs dans l'enzyme, sur un site de liaison plus ou moins spécifique, qui, une fois occupé modifie suffisamment la structure tridimensionnelle de l'enzyme pour ralentir l'acte catalytique sans empêcher la liaison du substrat. Il n'y a donc pas de compétition entre l'inhibiteur et le substrat. L'effet est concentration-dépendant mais n'annule jamais complétement la vitesse. On peut proposer le schéma suivant :
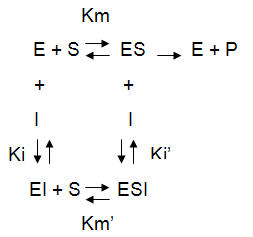
L'inhibiteur se fixant indépendamment du substrat, il peut se lier aussi bien sur E que sur ES, mais peut-être pas exactement avec le même Ki, d'où un Ki'. Ces différences de Ki, et éventuellement de Km', ne sont pas étudiables par les méthodes classiques ; là encore, il faudra faire appel aux méthodes de stopped-flow (cinétiques rapides) ou de Scatchard (études de liaison, par exemple par Résonance Plasmonique de Surface, ou RPS).
