Exercice 4
L'anhydrase carbonique (AC) catalyse l'hydratation réversible du CO2 produit par la respiration selon l'équilibre :
CO2 + H2O <-> H2CO3 <-> HCO3- + H+
Cette enzyme est fortement inhibée par l'acétazolamide, un médicament diurétique car l'AC intervient aussi au niveau rénal pour réguler la réabsorption de sels minéraux. Cette réaction bi-bi peut être traitée comme une réaction à un substrat (le CO2 gazeux dissous dans l'eau) et un produit (l'ion bicarbonate soluble dans l'eau). On désire connaître les effets inhibiteurs de l'acétazolamide sur l'enzyme purifiée, placée en solution dans les conditions conventionnelles pour déterminer des activités enzymatiques. Les résultats de mesures de v0 en absence et en présence de l'inhibiteur sont donnés sous forme d'un graphe d'Eadie-Hofstee :
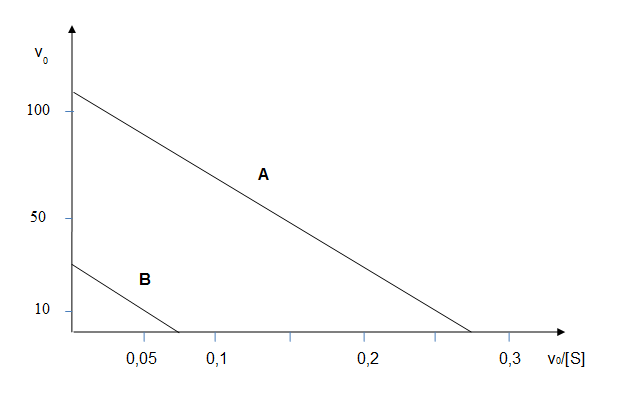
v0 en μmole.s-1 et v0/[S] en s-1.L
Courbe A : sans inhibiteur
Courbe B : avec inhibiteur (6.10-5 M)
Question
Donnez les valeurs de Vm et Km de l'AC pour le CO2 à partir du graphe.
Rappelons que l'équation du graphe d'Eadie-Hofstee est :
v0 = - Km.v0/[S] + Vm
Donc, Vm = v0 quand v0/[S] = 0, soit la valeur de l'intersection de la droite avec l'axe des ordonnées ; ainsi Vm = 110 μmole.s-1. Et quand v0= 0, alors Km = Vm/(v0/[S]) = 110/0,275 = 4.10-4 mole.L-1, la valeur de v0/[S] étant lue à l'intersection de la droite avec l'axe des abscisses.
Question
Puis déduisez de ce même graphe la nature de l'inhibition réalisée par l'acétazolamide. Cette inhibition est-elle stricte ? Justifiez votre réponse. Et calculez le Ki de l'AC pour cet inhibiteur.
La droite obtenue avec l'inhibiteur est parallèle à celle obtenue en son absence, donc la pente est la même (Km et Kmapp sont identiques), alors que Vmapp est diminuée (sur les deux axes) ; il s'agit donc d'un inhibiteur non compétitif. L'inhibition non compétitive est stricte, car les deux droites sont strictement parallèles (un seul Km). On peut calculez le Ki par la relation :
Vmapp = Vm/(1 + [I]/Ki)
dont on peut extraire Ki selon Vmapp/Vm = 1 + [I]/Ki puis Ki = Vmapp.[I]/(Vm - Vmapp) = 30.10-6.60.10-6/(110 - 30)10-6 = 2,25.10-5 mole.L-1.
Question
Connaissant la Mr de l'AC (30 kDa) et la quantité d'enzyme (10 μg) utilisée sous forme pure, calculez la constante catalytique kcat sachant que l'essai a été réalisé sur 1 mL.
Rappel :
Quelques rappels : on a vu que v0 = k2.[ES] et que Vm = kcat.[ET], ainsi kcat = Vm/[ET], ce qui nécessite de calculer [ET], ou plutôt de l'exprimer dans les bonnes unités car on sait que [ET] = 10 μg/mL. Ou plus simplement on peut rester en quantité, la Vm ayant été mesurée dans le même volume de 1 mL, donc :
- dans 1 mL, 10 μg d'AC de Mr = 30 kDa correspond à 10.10-6 g/30.103g.mole-1 soit 0,33.10-9 mole.
- et donc kcat = 110.10-6 mole.s-1/0,33.10-9 mole = 3,33.105 s-1 c'est-à-dire que l'AC catalyse la condensation de l'eau sur le gaz carbonique à la vitesse de 333000 moles par seconde, soit 333000.N molécules, N étant le nombre d'Avogadro.
