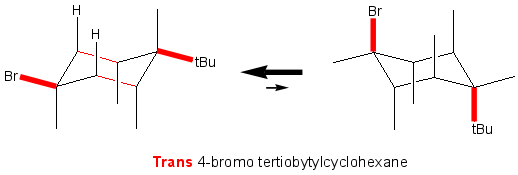
La conformation la plus stable du trans 4-bromo tertiobutylcyclohexane est celle où les deux substituants se trouvent en position équatoriale (eq-eq). La configuration trans avec les deux substituants en position axiale (ax-ax) n'existe pour ainsi dire pas (tertiobutyl volumineux et interactions 1-3).
L'élimination d'acide bromhydrique sur le trans 4-bromo tertiobutylcyclohexane (eq-eq) est une réaction d'ordre 2, E2. C'est une réaction stéréospécifique, une transélimination, et les éléments que vous éliminez doivent être obligatoirement dans un même plan et antiparallèles.
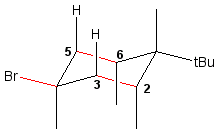
Sur ce cyclane halogéné, il n'y a pas d'hydrogène antiparallèle au brome, il n'y a donc pas d'élimination d'HBr (ce sont les liaisons 2,3 et 5,6 du cyclane qui sont antiparallèles à cet atome de brome en position équatoriale).
La trans-élimination E2 d'un substituant en position équatoriale est impossible.
Si vous faites une interconversion du cyclane, le brome se trouve alors en position axiale (l'élimination possible) MAIS dans cette conformation, le tertiobutyle est également en position axiale, et la structure n'est pas stable. Si il y a élimination, elle se fait avec un rendement très très très faible.
Ce que vous dites sur le cis 4-bromo-tertiobutyl cyclohexane avec Br axial est exact. Sur les carbones voisins, il y a bien des atomes d'hydrogène en position axiale, donc en anti de Br. L'élimination E2 de HBr est possible. La trans-élimination E2 d'un substituant en position axiale est possible.
L'élimination d'Hofmann doit être considérée comme une élimination normale. Si c'est une élimination E2, elle n'est réalisable que lorsque l'ammonium est en position axiale.