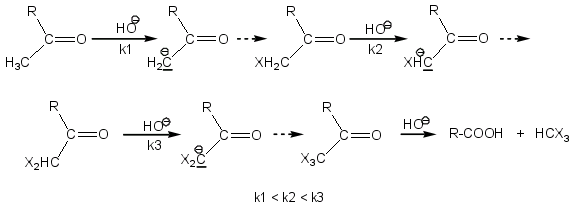
En milieu basique
On forme tout d’abord l’énolate qui réagit ensuite sur l’halogène pour donner le dérivé monohalogéné.
Une fois que le premier atome d’halogène X est fixé, les deux atomes d’hydrogène du groupement -CH2X sont plus acides que les trois atomes d’hydrogène de -CH3 initial (effet –I de l’halogène augmente le caractère acide des hydrogènes) ; l’action de la base devient donc de plus en plus facile au fur et à mesure des halogénations ce qui explique pourquoi il y a polyhalogénation d’une cétone en milieu alcalin. La réaction continue en milieu basique jusqu’à la formation d’haloforme HCX3 et d’acide R-COOH.
En milieu acide
On forme tout d’abord l’énol de la cétone. Cette réaction débute par la fixation du proton sur l’oxygène du carbonyle CO. Plus les électrons de l’oxygène sont disponibles (caractère basique de l’oxygène), plus la fixation du proton est facile. L’énol réagit ensuite sur l’halogène pour donner le dérivé monohalogéné.
Sur la cétone monohalogénée, la fixation d’un proton sur l’oxygène du carbonyle est à présent plus difficile que dans la première étape. Ceci est dû à l’effet –I de l’halogène qui se fait sentir au niveau de l’oxygène : il diminue la densité électronique au niveau de cet atome (O) qui compense en attirant les électrons de ses doublets non liants ; de ce fait, les doublets sont moins accessibles (à rapprocher du caractère basique des amines primaires et secondaires : R-NH2 < R2NH); l'oxygène devient moins basique et la fixation du proton ainsi que la formation de l'énol plus difficile. C'est la raison pour laquelle on s'arrête au dérivé monohalogéné.